
【题目】在氧化还原反应中,氧化剂__电子,发生的反应是__反应;还原剂__电子,发生的反应是__反应。铁与氯气反应的方程式为__,生成物中铁是__价,铁与盐酸的反应化学方程式为___,生成物中铁是___价,这一事实证明,氯气的氧化性比盐酸的氧化性__(填“强”或“弱”)。
【答案】得到 还原 失去 氧化 2Fe+3Cl2![]() 2FeCl3 +3 Fe+2HCl═FeCl2+H2↑ +2 强
2FeCl3 +3 Fe+2HCl═FeCl2+H2↑ +2 强
【解析】
氧化还原反应中,氧化剂得到电子被还原,发生还原反应,而还原剂失去电子被氧化,发生氧化反应;Fe与氯气反应生成氯化铁,Fe与盐酸反应生成氯化亚铁,可知氯气得电子能力强,以此来解答。
氧化还原反应中,氧化剂得到电子被还原,发生还原反应,而还原剂失去电子被氧化,发生氧化反应;Fe与氯气反应生成氯化铁,该反应为2Fe+3Cl2![]() 2FeCl3,生成物中Fe元素的化合价为+3价,Fe与盐酸反应生成氯化亚铁,该反应为Fe+2HCl═FeCl2+H2↑,生成物中Fe元素的化合价为+2价,由两个反应可知氯气得电子能力比HCl强,即氯气的氧化性比盐酸的氧化性强,
2FeCl3,生成物中Fe元素的化合价为+3价,Fe与盐酸反应生成氯化亚铁,该反应为Fe+2HCl═FeCl2+H2↑,生成物中Fe元素的化合价为+2价,由两个反应可知氯气得电子能力比HCl强,即氯气的氧化性比盐酸的氧化性强,
故答案为:得到;还原;失去;氧化;2Fe+3Cl2![]() 2FeCl3;+3;Fe+2HCl═FeCl2+H2↑;+2;强。
2FeCl3;+3;Fe+2HCl═FeCl2+H2↑;+2;强。


科目:高中化学 来源: 题型:
【题目】下列实验所得结论正确的是
① | ② | ③ | ④ |
|
|
|
|
充分振荡试管,下层溶液红色褪去 | 溶液变红 | 溶液变红 | 充分振荡右侧小试管, 下层溶液红色褪去 |
A.①中溶液红色褪去的原因是:CH3COOC2H5+NaOH![]() CH3COONa+C2H5OH
CH3COONa+C2H5OH
B.②中溶液变红的原因是:CH3COO-+H2O![]() CH3COOH+H+
CH3COOH+H+
C.由实验①、②、③推测,①中红色褪去的原因是乙酸乙酯萃取了酚酞
D.④中红色褪去证明右侧小试管中收集到的乙酸乙酯中混有乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为Ts(中文名“![]() ”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱
D.中子数为176的Ts核素符号是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为氮及其化合物的类别与化合价对应的关系图。
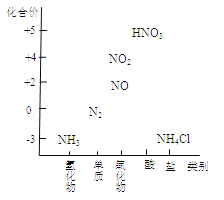
(1)实验室制取氨气。
① 化学方程式是_______。
② 可用向下排空气法收集氨气的原因是_______。
③ 用水吸收多余的氨气时,如将导管直接插入水中,
会产生倒吸现象,产生该现象的原因是_______。
(2)完成下列能生成NO的化学方程式:
① 体现N元素的还原性:
a. 汽车尾气中产生的NO:N2 + O2 ![]() 2NO。
2NO。
b. 氨的催化氧化:_________。
② 体现N元素的氧化性:_________。
(3)NO2 易溶于水。将体积为V mL的试管充满NO2后倒扣在水中,见下图。
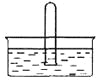
① NO2溶于水的化学方程式是_________。
② 使试管中NO2完全被水吸收的操作是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某高分子化合物R的结构简式如图,下列有关R的说法正确的是

A. R的单体之一的分子式为C9H12O2
B. R可通过加聚和缩聚反应合成,R完全水解后生成2种产物
C. R是一种有特殊香味,难溶于水的物质
D. 碱性条件下,1 mol R完全水解消耗NaOH的物质 的量为n(m+1)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号.请回答下列问题:
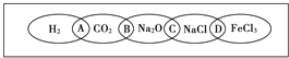
(1)请将分类依据代号填入相应的括号内:
(________)两种物质都不是电解质
(________)两种物质都是钠的化合物
(________)两种物质都是氧化物
(________)两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入上图中某种物质M的饱和溶液,继续煮沸至溶液呈红褐色.
①物质M的化学式为____________。
②证明有红褐色胶体生成的实验操作是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是( )
A. ![]() mol·L-1B.
mol·L-1B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1D.
mol·L-1D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烧杯A中盛放0.1mol/L的H2SO4溶液,烧杯B中盛放0.1mol/L的的CuCl2溶液(两种溶液均足量),组成的装置如图所示。下列说法不正确的是

A.A为原电池,B为电解池
B.当A烧杯中产生0.1mol气体时,B烧杯中产生气体的物质的量也为0.1mol
C.经过一段时间,B烧杯中溶液的浓度减小
D.将B中右侧石墨改为铜电极,电极上发生的反应不变
查看答案和解析>>
科目:高中化学 来源: 题型:
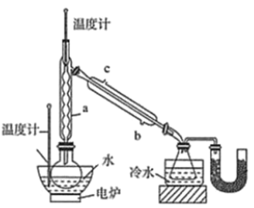
【题目】硼氢化钠(NaBH4)通常为白色粉末,容易吸水潮解,可溶于异丙胺(熔点:-101℃,沸点:33℃),在有机合成中被称为“万能还原剂”。制备硼氢化钠的流程如图:
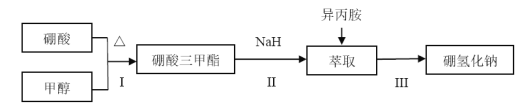
硼酸三甲酯的制备:将硼酸(H3BO3)和适量甲醇加入圆底烧瓶中,然后缓慢地加入浓硫酸,振荡,在烧瓶上加装分馏柱a,用电炉经水浴锅加热,回流2小时,收集硼酸三甲酯与甲醇共沸液。装置如图所示(夹持装置略去,下同)。
硼酸三甲酯B(OCH3)3 | 甲醇 | 甲醇钠 | |
溶解性 | 与乙醇、甲醇混溶,能水解 | 与水混溶 | 溶于甲醇,不溶于异丙胺 |
沸点/℃ | 68 | 64 | 450 |
硼酸三甲酯与甲醇混合物的共沸点为54℃ | |||
(1)直形冷凝管冷却水应从________(填“b”或“c”)接口进入。
(2)浓硫酸的作用是_______。
(3)本实验采用水浴加热,优点是________;U型管中试剂的作用是__________。
(4)在240℃条件下进行,硼酸三甲酯与氢化钠反应制取NaBH4,同时生成CH3ONa,写出该反应的化学方程式______。
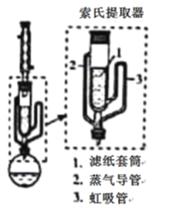
(5)萃取时可采用索氏提取法,其装置如图所示。实验时烧瓶中溶剂受热蒸发,蒸汽沿导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现连续萃取。当萃取完全后,硼氢化钠在_______(填“圆底烧瓶”或“索氏提取器”)中。
(6)分离NaBH4并回收溶剂,采用的方法是_______。
(7)“有效氢含量”可用来衡量含氢还原剂的还原能力,定义是:每克含氢还原剂的还原能力相当于多少克H2的还原能力。NaBH4的有效氢含量为_____________(保留两位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com