
| A. | FeCl2(NH4SCN溶液) | B. | KI(淀粉溶液) | ||
| C. | 白磷(紫色石蕊试液) | D. | Na2SO3( BaCl2 溶液) |
分析 A.亚铁离子易被氧化为铁离子;
B.碘离子能被氧化为碘单质;
C.白磷被氧化为五氧化二磷,遇水反应生成磷酸;
D.亚硫根离子能被氧化为硫酸根离子,都能与钡离子反应生成沉淀.
解答 解:A.亚铁离子易被氧化为铁离子,可利用NH4SCN溶液检验铁离子,若溶液为血红色来确定样品被氧化,故A正确;
B.碘离子能被氧化为碘单质,淀粉遇碘变蓝,则可利用淀粉溶液来确定样品被氧化,故B正确;
C.白磷被氧化为五氧化二磷,遇水反应生成磷酸,加紫色石蕊溶液变红,则可以确定样品被氧化,故C正确;
D.亚硫根离子能被氧化为硫酸根离子,都能与钡离子反应生成沉淀,则不能确定样品被氧化,故D错误;
故选D.
点评 本题考查物质检验及氧化还原反应,为高频考点,把握物质的性质、离子检验及发生的反应为解答的关键,侧重分析与应用能力的考查,注意变质混有的离子的性质,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 食品添加剂对人体的健康均无害,所以不用严格控制用量 | |
| B. | 棉、麻、丝、毛的主要成分都是纤维素 | |
| C. | 光纤的主要成分是二氧化硅 | |
| D. | 农业施肥所用的碳铵和尿素均属于无机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
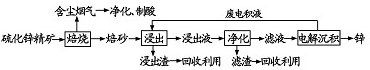
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
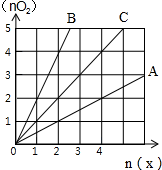
| A. | 2:1 | B. | 1:2 | C. | 1:1 | D. | 任意 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定有Al3+、Mg2+、Cl-,可能有NH4+ | |
| B. | 肯定有Al3+、Mg2+、HCO3-,肯定没有MnO4- | |
| C. | 肯定有K+、Al3+、MnO4-,可能有HCO3- | |
| D. | 肯定有Al3+、Mg2+、Cl-,可能有K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
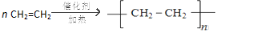 .
.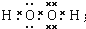 ;将乙加入浅绿色酸性溶液中,溶液变为棕黄色,写出该反应的离子方程式.
;将乙加入浅绿色酸性溶液中,溶液变为棕黄色,写出该反应的离子方程式. .与PH3相比,DC2易液化的主要原因是NH3中有氢键;
.与PH3相比,DC2易液化的主要原因是NH3中有氢键;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
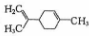 ,有关柠檬烯的分析正确的是( )
,有关柠檬烯的分析正确的是( )| A. | 一氯代物共有7种 | |
| B. | 分子中所有碳原子一定在同一平面 | |
| C. | 和丁基苯(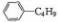 )互为同分异构体 )互为同分异构体 | |
| D. | 一定条件下,分别可以发生加成、取代、氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com