
| A. | 分子晶体在水中溶解时,只破坏分子间作用力 | |
| B. | 原子晶体中的各相邻原子都以非极性键相结合 | |
| C. | 分子晶体的熔沸点很低,常温下都呈液态或气态 | |
| D. | 含有金属阳离子的晶体不一定是离子晶体 |
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能:B>Be>Li | |
| B. | 电负性:F>N>O | |
| C. | Fe2+的最外层电子排布式为:3s23p63d6 | |
| D. | 基态铜原子的价电子排布图: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
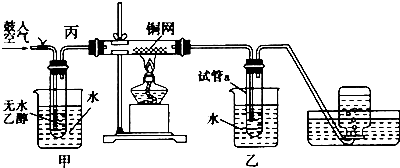
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
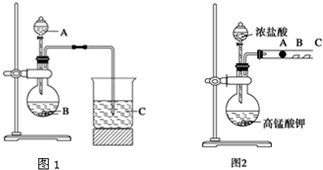
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K与F | B. | Na与Cl | C. | Al与S | D. | Mg与Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
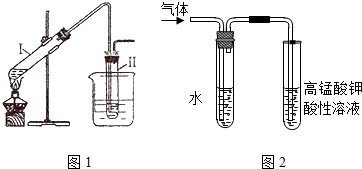
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 那浮在试管中的液面上 | B. | 钠沉入试管底部 | ||
| C. | 钠燃烧起来 | D. | 钠处于煤油和水的交界处 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
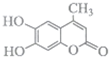
| A. | 该有机物分子式为 C10H10O4 | |
| B. | 1mol该有机物与 H2发生加成时最多消耗H2 5 mol | |
| C. | 1mol该有机物与足量溴水反应时最多消耗Br23 mol | |
| D. | 1mol该有机物与 NaOH 溶液反应是最多消耗NaOH 3 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com