
分析 (1)金属钠和水反应生成氢氧化钠和氢气,氧化钠与水反应生成氢氧化钠,根据氢气的质量计算未被氧化的金属钠的质量;
(2)根据钠的质量计算出氧化钠的质量,然后利用质量守恒定律计算出被氧化的钠的质量;
(3)根据钠和氧化钠的质量,利用质量守恒可计算出氢氧化钠的质量;利用质量守恒定律计算出溶液质量,反应后溶质为氢氧化钠,然后计算出所得溶液的质量分数.
解答 解:(1)金属钠和水反应生成氢氧化钠和氢气,氧化钠与水反应生成氢氧化钠,设10.8g反应物中含金属钠的质量为x,生成氢氧化钠的质量为y,
2Na+2H2O=2NaOH+H2↑
23×2 40×2 2
x y $\frac{2.24L}{2.24L/mol}$
则:x=4.6g,y=8g,
答:未被氧化的金属钠的质量为4.6g;
(2)反应物中含氧化钠:m(Na2O)=10.8g-4.6g=6.2g,
设氧化钠中钠元素(即被氧化的钠)的质量为z,则62:46=6.2g:z,解得:z=4.6g,
答:被氧化的金属钠的质量为4.6g;
(3)设氧化钠溶于水生成的氢氧化钠的质量为b,
Na2O+H2O=2NaOH
62 2×40
6.2g b
则:$\frac{62}{6.2g}$=$\frac{2×40}{b}$,解得:b=8g,
生成氢氧化钠的质量为:m(NaOH)=8g+8g=16g,计算溶质的质量分数,必须求出反应后溶液的总质量,m(H2)=$\frac{2.24L}{2.24L/mol}$×2g/mol=0.2g,根据质量守恒关系,
m(溶液)=m(H2O)+m(Na)+m(Na2O)-m(H2)=50g+10.8g-0.2g=60.6g,溶质的质量分数为:$\frac{16}{60.6}$×100%≈26.4%,
答:溶质的质量分数为26.4%.
点评 本题考查了有关钠及其化合物的混合物反应的计算,题目难度中等,掌握钠的性质以及明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的分析、理解能力及化学计算能力.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:推断题
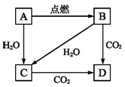 如图所示A是固体金属单质,燃烧时火焰呈黄色.
如图所示A是固体金属单质,燃烧时火焰呈黄色.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
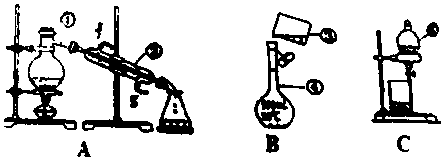
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
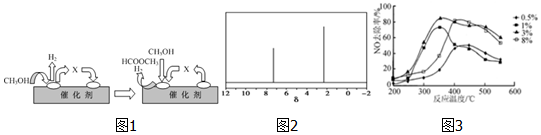
 CH3OH.
CH3OH. .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 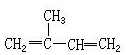 2-甲基-1,3-丁二烯 2-甲基-1,3-丁二烯 | B. | 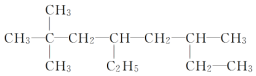 2,2-二甲基-4,6-二乙基庚烷 2,2-二甲基-4,6-二乙基庚烷 | ||
| C. |  1,3,4-三甲苯 1,3,4-三甲苯 | D. |  2-甲基-3-戊烯 2-甲基-3-戊烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
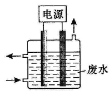 2015年8月12日23:30左右,天津滨海新区的一处集装箱码头发生爆炸,发生爆炸的是集装箱内的易燃易爆物品氰化钠,数量为700吨左右.
2015年8月12日23:30左右,天津滨海新区的一处集装箱码头发生爆炸,发生爆炸的是集装箱内的易燃易爆物品氰化钠,数量为700吨左右.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
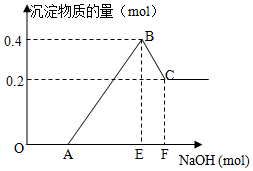 在HCl、MgCl2和AlCl3的混合溶液中滴加NaOH溶液至过量,如图
在HCl、MgCl2和AlCl3的混合溶液中滴加NaOH溶液至过量,如图查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com