
分析 (1)氮族元素的外围电子为其最外层上s、p能级电子;
基态磷原子中,电子占据的最高能层符号为M,该能层有1个s轨道、3个p轨道、5个d轨道;
(2)PH3分子中P原子价层电子对个数是4且含有一个孤电子对,根据价层电子对互斥理论判断该分子的VSEPR模型,成键电子对和孤电子对之间的排斥力小于孤电子对之间的排斥力,据此判断键角;
(3)氮的最高价氧化物为N2O5,由两种离子构成,其中阴离子构型为平面正三角形,化学式应为NO3-,则其阳离子的化学式为:NO2+,其中心原子价电子对数为$\frac{5-1}{2}$=2,根据价层电子对互斥理论判断原子杂化方式;
(4)①分子晶体中含有氢键的物质熔沸点较高;
②NF3中N-F成键电子对偏向于F原子,N原子上的孤对电子难与铜离子形成配离子;
(5)磷化硼结构如图所示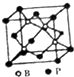 ,该晶胞中B原子为4个、P原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,每个P原子连接4个B原子,则磷原子的配位数为4;晶体中硼原子和磷原子的核间距(dB-P)等该晶胞体对角线的$\frac{1}{4}$,据此计算.
,该晶胞中B原子为4个、P原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,每个P原子连接4个B原子,则磷原子的配位数为4;晶体中硼原子和磷原子的核间距(dB-P)等该晶胞体对角线的$\frac{1}{4}$,据此计算.
解答 解:(1)氮族元素的外围电子为其最外层上s、p能级电子,则氮族元素外围电子排布式为ns2np3;
基态磷原子中,电子占据的最高能层符号为M,该能层有1个s轨道、3个p轨道、5个d轨道,所以有9个轨道,
故答案为:ns2np3;M;9;
(2)PH3分子中P原子价层电子对个数是4且含有一个孤电子对,根据价层电子对互斥理论判断该分子的VSEPR模型为四面体形,成键电子对和孤电子对之间的排斥力小于孤电子对之间的排斥力,氨气分子中只含一个孤电子对、水分子中含有两个孤电子对,所以键角,故答案为:四面体形;>;
(3)氮的最高价氧化物为N2O5,由两种离子构成,其中阴离子构型为平面正三角形,化学式应为NO3-,则其阳离子的化学式为:NO2+,其中心原子价电子对数为$\frac{5-1}{2}$=2,根据价层电子对互斥理论判断原子杂化方式为sp,
故答案为:sp;
(4)①NH3存在氢键,而NF3只存在分子间作用力,两种作用力前者较强,物质的沸点较高,
故答案为:NH3能形成氢键,NF3只有范德华力;
②F的电负性大于N元素,NF3中N-F成键电子对偏向于F原子,N原子上的孤对电子难与铜离子形成配离子,所以NF3不易与Cu2+形成配离子,
故答案为:F的电负性大于N元素,NF3中N-F成键电子对偏向于F原子,N原子上的孤对电子难与铜离子形成配离子;
(5)磷化硼结构如图所示 ,该晶胞中B原子为4个、P原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,每个P原子连接4个B原子,则磷原子的配位数为4;晶体中硼原子和磷原子的核间距(dB-P)等该晶胞体对角线的$\frac{1}{4}$=$\frac{1}{4}$×$\sqrt{3}$a=$\frac{1}{4}$×$\sqrt{3}$×478pm=207pm,
,该晶胞中B原子为4个、P原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,每个P原子连接4个B原子,则磷原子的配位数为4;晶体中硼原子和磷原子的核间距(dB-P)等该晶胞体对角线的$\frac{1}{4}$=$\frac{1}{4}$×$\sqrt{3}$a=$\frac{1}{4}$×$\sqrt{3}$×478pm=207pm,
故答案为:207.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、氢键、键角、微粒空间构型、原子核外电子排布等知识点,侧重考查学生知识应用、计算、空间想象能力,难点是晶胞计算,注意该晶胞中B-P原子核间距与体长关系,题目难度中等.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 原电池是将化学能转化为电能的装置 | |
| B. | 原电池负极发生氧化反应 | |
| C. | 原电池中,阳离子向负极移动 | |
| D. | 原电池电子流出的一极为负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硒化氢的稳定性比水的弱 | |
| B. | 硒化氢的水溶液显弱酸性 | |
| C. | 硒的氧化性比硫的强 | |
| D. | 硒的最高价氧化物对应的水化物酸性比砷的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,表示的分子式C6H14名称是2-甲基戊烷
,表示的分子式C6H14名称是2-甲基戊烷 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
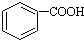 >H2CO3>
>H2CO3>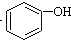 ,将
,将 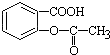 转变为
转变为 的方法是( )
的方法是( )| A. | 与足量的NaOH溶液共热,再通入CO2 | |
| B. | 与稀H2SO4共热后,加入足量的NaOH溶液 | |
| C. | 加热溶液,通入足量的CO2 | |
| D. | 与稀H2SO4共热后,加入足量的NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中滴加盐酸酸化的BaCl2溶液,产生白色沉淀,则溶液中一定含有SO42- | |
| B. | 用加热法可除去NaHCO3中少量的Na2CO3 | |
| C. | 浓硝酸保存在棕色试剂瓶中 | |
| D. | 酸碱中和滴定时,锥形瓶需用待测液润洗后,再加入待测液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
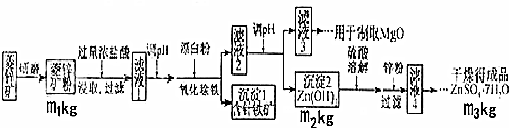
| 沉淀化学式 | Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 |
| 开始沉淀的pH | 10.4 | 6.4 | - | - |
| 沉淀完全的pH | 12.4 | 8.0 | - | - |
| 开始溶解的pH | - | 10.5 | - | - |
| Ksp | 5.6×10-12 | - | 6.8×10-6 | 2.8×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
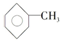 ,已知甲苯的一氯代物有4种,则甲苯完全氢化后的环烷烃的一氯代物有( )
,已知甲苯的一氯代物有4种,则甲苯完全氢化后的环烷烃的一氯代物有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com