
| A. | 过滤所需实验用品有漏斗、烧杯、玻璃棒、铁架台(带铁圈) | |
| B. | 过滤时把漏斗放在铁三脚架上 | |
| C. | 过滤时将玻璃棒斜靠在三层滤纸上 | |
| D. | 过滤时为了加快过滤速度,用玻璃棒搅拌过滤器中的液体 |
分析 实验用品有漏斗、滤纸、烧杯、玻璃棒、铁架台(带铁圈);过滤实验时,滤纸要紧贴漏斗内壁;滤纸边缘要低于漏斗边缘,漏斗内液体的液面低于滤纸边缘;烧杯嘴紧靠引流的玻璃棒,玻璃棒的末端轻靠在三层滤纸的一边,漏斗下端紧靠接受的烧杯的内壁.
解答 解:A.实验用品有漏斗、滤纸、烧杯、玻璃棒、铁架台(带铁圈),故A错误;
B.过滤时把漏斗放在铁架台的铁圈上,故B错误;
C.过滤时,玻璃棒的末端轻靠在三层滤纸的一边,故C正确;
D.过滤时不能用玻璃棒搅拌,防止捣破滤纸,故D错误.
故选C.
点评 本题考查了基本实验操作,明确过滤的原理和装置是解题的关键,注意过滤实验一定要遵循“一贴二低三靠”原则,否则就会使过滤实验失败.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,35.5g的氯气与足量的氢氧化钙溶液完全反应,转移的电子数为0.5NA | |
| B. | 60g甲酸甲酯和葡萄糖的混合物含有的碳原子数目为2NA | |
| C. | 标准状况下,2.24L PH3与3.4gH2S气体分子所含电子数目均为1.8NA | |
| D. | 已知合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,当该反应生成NA个NH3分子时,反应放出的热量小于46.2kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 2016年9月4日,G20峰会召开,扬州天空呈现出干净的蓝色,云彩随意地铺散在天空,纯净透明,出现了持续的“水晶天”.
2016年9月4日,G20峰会召开,扬州天空呈现出干净的蓝色,云彩随意地铺散在天空,纯净透明,出现了持续的“水晶天”.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol氖气中含有的原子数目为NA | |
| B. | 5.85g NaCl中含有的最外层电子数目为1.6NA | |
| C. | 2mol NO和1mol O2混合,充分反应后转移的电子数目为4NA | |
| D. | 25℃时,1L 0.1mol•L-1 Na2S溶液中的阴离子数目小于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ②③④ | C. | ②④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
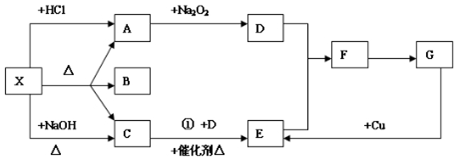
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com