
【题目】一定温度下的密闭容器中发生可逆反应C(s)+H2O(g) ![]() CO(g)+H2(g),一定能说明该反应己达到平衡状态的是( )
CO(g)+H2(g),一定能说明该反应己达到平衡状态的是( )
A.v逆(H2O)=v正(CO) B.容器中物质的总质量不发生变化
C.n(H2O):n(H2)=1:1 D.生成lmolCO的同时生成lmolH2
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
【题目】第ⅤA族元素中的A、B两种元素所在周期分别最多可排18和8种元素,且B在A的上一周期,当A的原子序数为x时,B的原子序数为( )
A. x﹣18 B. x﹣8 C. x+8 D. x+18
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有两个无标签的试剂瓶,分别装有Na2CO3和NaHCO3,有四位同学为鉴别它们,采用了以下不同方法,其中可行的是( )
A. 分别配成溶液,再通入CO2
B. 分别配成溶液,再加入NaOH溶液
C. 分别加热,再称量加热前后质量是否有变化
D. 分别配成溶液,再进行焰色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢是重要的氧化剂和还原剂,常周于消毒、杀菌、漂白等。某化学兴趣小组同学.围绕着过氧化氢开展了调査研究与实验。
I.调查
(1)过氧化氢常用于消毒、杀菌、漂白等方面的主要原因是 。
(2)制备过氧化氢目前最常用的是乙基蒽醌法,其主要过程可以用下图表示,此过程中与Pd起相同作用的物质为 (写名称)。
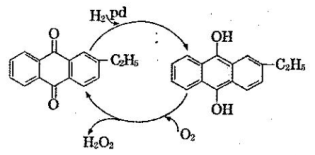
Ⅱ.不稳定性实验研究
(3)为了探究温度、催化剂等外界条件对 H2O2的分解速率的影响,某兴趣小组同学设计了如下三组实验,部分实验数据已经填在下面表中。
实验编号 | T/X | H202初始浓度/moL· L-1 | FeCl3初始浓度/ moL· L-1 moL· L-1L-1 |
I | 20 | 1.0 | |
II | 50 | 1.0 | 0 |
III | 50 | 0.1 |
①实验I、Ⅱ研究___________对分解速率的影响,实验Ⅱ、Ⅲ研究催化剂对分解速率的影响,则实验Ⅲ中H2O2初始浓度应为 moL· L-1。
②三组实验中分解速率最慢的是 (填编号)。
III.过氧化氢含量的实验测定
兴趣小组同学用0.100 0 moL·L-1酸性高锰酸钾标准溶液滴定试样中过氧化氢的含量,反应原理为 2MnO4- +5H2O2 +6H+ =2Mn2+ +8H2O+5O2↑
(4)滴定到达终点的现象是_ 。
(5)用移液管吸取25.00 mL试样置于锥形瓶中,重复滴定四次,每次消耗的KMnO4 标准溶液体积如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
计算试样中过氧化氢的浓度为__________moL·L-1 (保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的数值。下列说法中正确的是( )
A.0.1 mol Cl2与足量NaOH溶液反应,转移电子数为0.2 NA
B.0.1 mol金属钠在过量氧气充分燃烧,生成的化合物中离子总数为0.15 NA
C.常温常压下,100 mL 0.5 mol/L的乙二酸溶液中,总的离子数目大于0.15 NA
D.10 g D2O所含的中子数为4 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对一些物质或化学反应的分类以及依据正确的是( )
A. 豆浆是胶体,因为豆浆中的分散质粒子直径在1nm~100nm之间
B. NaCl溶液是电解质,因为NaCl溶液能导电
C. Na和H2O的反应不是离子反应,因为反应中没有离子参加
D. H2SO4是酸,因为H2SO4中含有氢元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.1g平均相对分子质量为7.2的CO与H2组成的混合气体与足量的O2充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加
A. 2.1g B. 3.6g C. 7.2g D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题小组以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵矾:
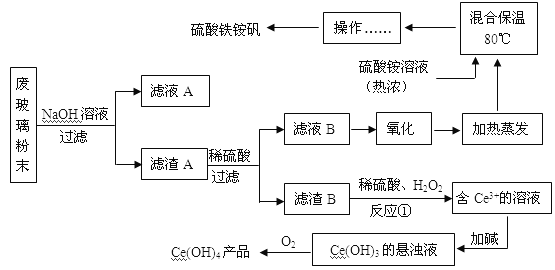
已知:
Ⅰ.酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce3+易水解,Ce4+有较强氧化性;
Ⅱ.CeO2不溶于稀硫酸;
Ⅲ.硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O]广泛用于水的净化处理。
(1)滤液A的主要成分 (填写化学式)。
(2)写出反应①的离子方程式 。
(3)反应①之前要洗涤滤渣B,对滤渣B进行洗涤的实验操作方法是 。
(4)稀土元素的提纯,还可采用萃取法。已知化合物HT作为萃取剂能将铈离子从水溶液中萃取出来,过程表示为Ce2(SO4)3 (水层)+ 6HT(有机层)![]() 2CeT3 (有机层)+3H2SO4(水层) ,分液得到CeT3 (有机层),再加入H2SO4 获得较纯的含Ce3+的水溶液。可选择硫酸作反萃取剂的原因是 。
2CeT3 (有机层)+3H2SO4(水层) ,分液得到CeT3 (有机层),再加入H2SO4 获得较纯的含Ce3+的水溶液。可选择硫酸作反萃取剂的原因是 。
(5)用滴定法测定制得的Ce(OH)4产品纯度。
![]()
所用FeSO4溶液在空气中露置一段时间后再进行滴定,则测得该Ce(OH)4产品的质量分数 。(填“偏大”、“偏小”或“无影响”)
(6)已知Fe3+沉淀的pH范围:2.2~3.2,Fe2+沉淀的pH范围:5.8~7.9,Zn2+沉淀的pH范围:5.8~11.0,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。现用FeSO4溶液(含有ZnSO4杂质)来制备硫酸铁铵矾。实验中可选用的试剂: KMnO4溶液、30%H2O2、 NaOH溶液、饱和石灰水、稀H2SO4溶液、稀盐酸。
实验步骤依次为:
向含有ZnSO4杂质的FeSO4溶液中,加入足量的NaOH溶液至pH>11, ;
② ;
③向②中得到的溶液中加入硫酸铵溶液, ,过滤、洗涤、常温晾干,得硫酸铁铵晶体(NH4) Fe(SO4)2·12H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg/mol。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________mol。
(2)该气体所含原子总数为________个。
(3)该气体在标准状况下的体积为________L。
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为____________。设溶液的密度为ρg/cm3,则该溶液的物质的量浓度为__________mol·L-1。
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com