
| A、在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
B、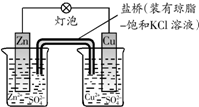 如图中电子由Zn极流向Cu,盐桥中的Cl-移向CuSO4溶液 |
| C、氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为O2+4H++4e-═2H2O |
| D、电镀时,通常把待镀的金属制品作阳极 |


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
| 元素代号 | X | Y | Z | R | T |
| 原子半径/nm | 0.186 | 0.160 | 0.143 | 0.104 | 0.066 |
| 主要化合价 | +1 | +2 | +3 | +6、-2 | -2 |
| A、氢化物的沸点为H2T<H2R |
| B、Y2+的半径比T2-的半径大 |
| C、Z2R3不能在水溶液中存在 |
| D、元素X和T形成的化合物中不可能含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用热碱液清洗铝材表面的油污时,会有气泡冒出 |
| B、电解精炼铜,电解结束后电解液浓度不变 |
| C、Fe2+、H+、NO3-三者不共存的原因为:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
| D、硬铝是以铝为主要合金元素的合金材料,其熔点低于纯铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在pH=1的溶液中:K+、Na+、SO42-、HCO3- | ||
| B、在0.1mol?L-1 Na2CO3溶液中:Al3+、K+、NO3-、SO42- | ||
| C、在0.1mol?L-1 FeCl3溶液中:K+、NH4+、I-、SCN- | ||
D、在
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 |
| B、地沟油经过处理后可作为汽车燃油,故地沟油主要成分是液态烃 |
| C、实施化石燃科脱硫,脱硝可以减少硫的氧化物和氮的氧化物的排放 |
| D、雾霾天气中的主要污染物是PM2.5,其中含氮的有机物和光发生化学作用,可形成光化学烟雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烷、乙烯和苯在工业上都可通过石油分馏得到 |
| B、米酒变酸的过程涉及了氧化反应 |
| C、乙烯和聚丙烯都能与氢气在一定条件下发生加成反应 |
| D、淀粉、葡萄糖、脂肪和蛋白质在一定条件下都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用浓硝酸做试剂比较铁和铜的金属活动性 |
| B、用干燥洁净的玻璃棒蘸取氯水滴在干燥PH试纸上,测定氯水的PH |
| C、向两只分别装有碳酸钠和碳酸氢钠固体的试管中各加几滴水,前者温度降低,后者温度升高 |
| D、欲检验Br-的存在,可在溶液中先加入氯水,再加入CCl4,振荡、静置,观察下层溶液是否出现橙红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,9g H2O中含NA个O-H键 |
| B、1mol Fe2+与足量稀硝酸反应,转移3NA个电子 |
| C、常温常压下,22.4L SO2和O2的混合气体中含2NA个氧原子 |
| D、0.1mol?L-1 KAl(SO4)2溶液中含0.2NA个SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
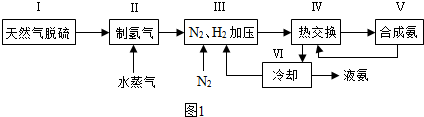
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com