
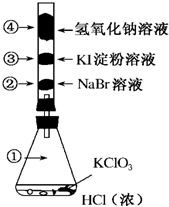
 已知常温下氯酸钾与浓盐酸反应放出氯气,现按如图进行氯、溴、碘的性质实验.玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )
已知常温下氯酸钾与浓盐酸反应放出氯气,现按如图进行氯、溴、碘的性质实验.玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )| A. | ①黄绿色 ②橙色 ③蓝色 ④白色 | B. | ①无色 ②橙色 ③紫色 ④白色 | ||
| C. | ①黄绿色 ②橙色 ③蓝色 ④无色 | D. | ①黄绿色 ②无色 ③紫色 ④白色 |
分析 根据题给信息,常温下氯酸钾与浓盐酸反应放出Cl2,氯气的颜色是黄绿色;氯气可以和NaBr溶液发生置换反应生成Br2;氯气和KI溶液反应置换出I2,还氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠的水溶液.
解答 解:常温下氯酸钾与浓盐酸反应放出Cl2,氯气的颜色是黄绿色①处充满黄绿色Cl2;
氯气进入玻璃管后与②处NaBr溶液发生置换反应生成Br2,液溴的水溶液颜色为橙色,所以白色棉球变为橙色;
氯气和③处KI溶液反应置换出I2,遇淀粉变蓝;
④处利用氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠的水溶液,用来进行Cl2的尾气吸收,尽管反应生成的物质均为无色,但棉球本身是白色的,所以④处的颜色为白色.
故选:A.
点评 氯气是一个重要的知识点,命题者设计出简洁的一器多用实验装置,并以装置图形式给考生呈现出来,将Cl2的制备、性质和溴、碘单质的颜色、检验联系在一起.考查学生对所学知识的理解能力及对知识在新的情景下的迁移能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

| 实验操作步骤 | 实验现象 | 结论 |
| Ⅰ取样; | 加入KSCN溶液溶液变红; | 溶液中存在Fe3+; |
| Ⅱ取样. | 加入酸性KMnO4溶液颜色褪去. | 溶液中存在Fe2+. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下列各种物质,有的具有多个官能团:请填写下列空白(填编号):
下列各种物质,有的具有多个官能团:请填写下列空白(填编号):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ③④⑤⑥ | C. | ②③④⑤ | D. | ①②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3 kJmor-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+202 (g)═C02 (g)+2H20(g)△H=-890.3kJ mol-1 | |
| B. | 500 V、30MPa下,将0.5molN2和1.5 molH2置于密闭的容器中充分反应生成 NH3(g),放热19.3kJ,其热化学方程式为 N2(g)+3H2 (g)$?_{500℃、30Mp}^{催化剂}$2NH3(g)△H=-38.6 kJmol-1 | |
| C. | 同温同压下,等物质的量的H2与足量的C12在光照和点燃条件下充分反应,所产生的热量相同 | |
| D. | 已知中和热为57.3 kJ/mol,则稀硫酸与氢氧化钡溶液反应的热化学方程式为 2H+(aq)+SO42-(aq)+Ba2+(aq)+20H-(aq)=BaS04 (s)+2H20(l)△H=-57.3kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
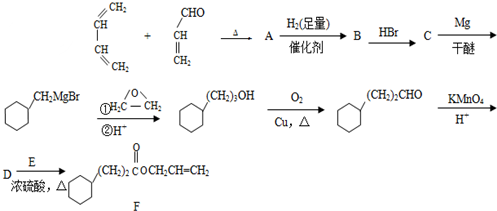

 ,A中所含官能团的名称是醛基、碳碳双键;
,A中所含官能团的名称是醛基、碳碳双键; ;
; ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com