
 某无色稀溶液X中,可能含有下表所列离子中的某几种.
某无色稀溶液X中,可能含有下表所列离子中的某几种.| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Cu2+、Mg2+、NH4+、Na+ |
4-
| ||
| 2 |
| 1 |
| 3 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:阅读理解
2- 4 |
- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:| 族 周期 |
IA | 0 | 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 2 | ② | ③ | ④ | 3 | ⑤ | ⑥ | ⑦ | ⑧ |
查看答案和解析>>
科目:高中化学 来源:2013届山西省忻州市高三第一次联考化学试卷(带解析) 题型:填空题
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题: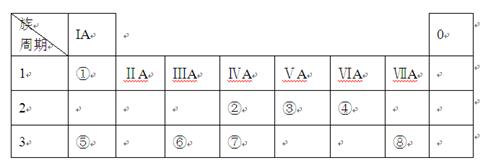
(1)⑤、⑥、⑦元素的原子半径由大到小的顺序为 。 (2)②、③、⑦元素的最高价含氧酸的酸性由强到弱的顺序是 。
(2)②、③、⑦元素的最高价含氧酸的酸性由强到弱的顺序是 。 (3)由表中两种元素的原子按1︰1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号) 。
(3)由表中两种元素的原子按1︰1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号) 。 a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4 (4)元素⑥的氯化物溶液与稀氨水溶液反应的离子方程式 。
(4)元素⑥的氯化物溶液与稀氨水溶液反应的离子方程式 。
工业上冶炼单质⑥的反应原理 。
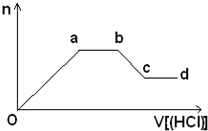
(5)某无色稀溶液X含有四种阴离子,是由②④⑥⑦⑧元素中的一种或两种组成。现取该溶液适量,向其中加入稀盐酸,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示。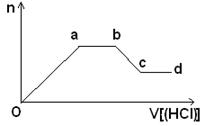
则oa段转化为沉淀的离子(指来源于X溶液,下同)是________,ab段发生反应的离子是________,bc段发生反应的离子方程式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年陕西省高三上学期第二次月考理综化学试卷(解析版) 题型:选择题
(1)锡为第ⅣA族元素,锡的单质和化合物与某些物质的化学性质有许多相似之处。已知锡元素具有如下性质:
 ;
;




 。
。
试回答:
①锡溶于盐酸,再向反应后的溶液中通入氯气,有关反应类似于铁的相应变化,试写出有关反应的化学方程式:_____________________________________________________,_______________________________________。
②将①中溶液蒸干后继续灼烧所得固体,变化过程类似于FeCl3溶液相应的变化,则最后得到的固体物质是__________(填化学式)。
③若可用SnCl2溶液与过量的碱溶液反应的方法制Sn(OH)2,该碱可选用________。
(2)某无色稀溶液X中,可能含有下表所列离子中的某几种。
|
阴离子 |
|
|
阳离子 |
|
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y体积(V)的关系如图所示。

①若Y是盐酸,则溶液中含有的金属阳离子是_________,ab段发生反应的离子方程式为_______________,图中oa段参加反应的阴离子的物质的量之比为___________________。
②若Y是NaOH溶液,则bc段反应的离子方程式为____________________。
若不考虑离子的水解,忽略H+和OH-的影响,且溶液中只存在四种离子,则它们的离子个数比为_____________________________________________(按阳离子在前,阴离子在后,高价在前,低价在后的顺序排列)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山西省忻州市高三第一次联考化学试卷(解析版) 题型:填空题
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
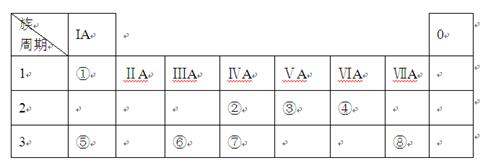
(1)⑤、⑥、⑦元素的原子半径由大到小的顺序为 。
(2)②、③、⑦元素的最高价含氧酸的酸性由强到弱的顺序是 。
(3)由表中两种元素的原子按1︰1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号) 。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(4)元素⑥的氯化物溶液与稀氨水溶液反应的离子方程式 。
工业上冶炼单质⑥的反应原理 。
(5)某无色稀溶液X含有四种阴离子,是由②④⑥⑦⑧元素中的一种或两种组成。现取该溶液适量,向其中加入稀盐酸,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示。
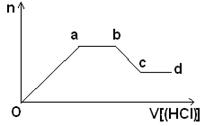
则oa段转化为沉淀的离子(指来源于X溶液,下同)是________,ab段发生反应的离子是________,bc段发生反应的离子方程式为_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com