
| A. | N×10-2mol•L-1 | B. | $\frac{N}{1.024×1{0}^{22}}$mol•L-1 | ||
| C. | $\frac{N}{6.02×1{0}^{21}}$mol•L-1 | D. | $\frac{N}{6.02×1{0}^{25}}$mol•L-1 |
分析 根据n=$\frac{N}{{N}_{A}}$计算Na+的物质的量,而n(Na2R)=$\frac{1}{2}$n(Na+),再根据c=$\frac{n}{V}$计算Na2R溶液的物质的量浓度.
解答 解:Na+的物质的量=$\frac{N}{6.02×1{0}^{23}mo{l}^{-1}}$=$\frac{N}{6.02×1{0}^{23}}$mol,n(Na2R)=$\frac{1}{2}$n(Na+)=$\frac{N}{1.204×1{0}^{24}}$mol,则Na2R溶液的物质的量浓度=$\frac{\frac{N}{1.204×1{0}^{24}}mol}{0.01L}$=$\frac{N}{1.024×1{0}^{22}}$mol•L-1,
故选:B.
点评 本题考查物质的量浓度计算,比较基础,注意掌握以物质的量为中心的计算.


 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 稀 H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氯气和水反应:Cl2+H2O═Cl-+ClO-+2H+ | |
| C. | 碳酸钡与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | 氯气和石灰乳反应:Ca(OH)2+Cl2═Ca2++Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
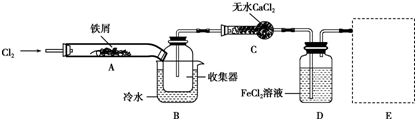
 ,沸点206℃)是合成苯甲醛的中间体,实验室合成苄叉二氯的装置如图所示.
,沸点206℃)是合成苯甲醛的中间体,实验室合成苄叉二氯的装置如图所示.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
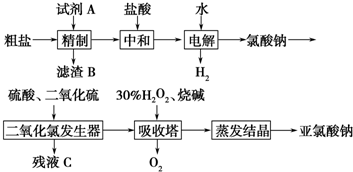
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a1=a2>a3 | B. | a1>a2>a3 | C. | a1=a2<a3 | D. | a1<a2<a3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 现象 | 结论 | |
| A | 将过量的CO2通入CaCl2溶液中 | 无白色沉淀出现 | 生成的Ca(HCO3)2可溶于水 |
| B | 常温下将Al片插入浓硫酸中 | 无明显现象 | Al片和浓硫酸不反应 |
| C | 将铜片放入过量的稀硝酸中 | 生成无色气体,后观察到红棕色 | NO遇氧气反应生成红棕色的NO2 |
| D | 将SO2通入溴水中 | 溶液褪色 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 活化分子之间的碰撞一定是有效碰撞 | |
| B. | 增大反应物的浓度,可使单位体积内活化分子增多,反应速率加快 | |
| C. | 对于有气体参加的反应增大压强,可使单位体积内活化分子增多,反应速率加快 | |
| D. | 催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com