

分析 (1)铁有三种常见的氧化物:FeO、Fe2O3、Fe3O4;
(2)Fe3O4与稀盐酸反应后的溶液中含Fe2+、Fe3+,可用KSCN溶液检验Fe2+可以用铁氰化钾溶液;
(3)加入氢氧化钠生成Fe(OH)2,Fe(OH)2不稳定,易被空气中的氧气氧化生成Fe(OH)3;
(4)反应流程所用原料为绿矾和氢氧化钠,除生成Fe3O4外,副产品为Na2SO4•10H2O(或Na2SO4),从溶液中分离出硫酸铜晶体应为将热溶液冷却结晶、过滤、洗涤、干燥.
解答 解:(1)铁有三种常见的氧化物:FeO、Fe2O3、Fe3O4,
故答案为:FeO、Fe2O3;
(2)Fe3O4与稀盐酸反应后的溶液中含Fe2+、Fe3+,可用KSCN溶液检验Fe2+可以用铁氰化钾溶液,可取待测液少许于试管中,加入适量的铁氰化钾溶液,若溶液显蓝色,则证明含Fe2+,
故答案为:铁氰化钾溶液;
(3)加入氢氧化钠生成Fe(OH)2,Fe(OH)2不稳定,易被空气中的氧气氧化生成Fe(OH)3,反应的化学方程式为4Fe(OH)2+2H2O+O2=4Fe(OH)3,
故答案为:4Fe(OH)2+2H2O+O2=4Fe(OH)3;
(4)反应流程所用原料为绿矾和氢氧化钠,除生成Fe3O4外,副产品为Na2SO4•10H2O(或Na2SO4),由硫酸钠溶液变为失去结晶水的硫酸钠的过程为:加热浓缩,冷却,结晶,过滤,洗涤,即bcad,
故答案为:Na2SO4•10H2O(或Na2SO4);bcad.
点评 本题考查较为综合,对学生的心理素质有非常高的要求,考查学生对工艺流程的理解、阅读题目获取信息能力、物质分离提纯等基本操作、离子检验等,难度中等,要求学生要有扎实的实验基础知识和灵活应用信息、基础知识解决问题的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
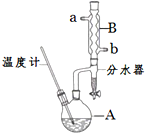 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:| 相对分子质量 | 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2 | B. | KMnO4 | C. | FeCl3 | D. | HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
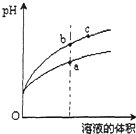 某温度下,相同pH的盐酸和醋酸分别加水稀释,pH随溶液体积变化的曲线如图所示,据图判断下列说法正确的是( )
某温度下,相同pH的盐酸和醋酸分别加水稀释,pH随溶液体积变化的曲线如图所示,据图判断下列说法正确的是( )| A. | b点酸的总浓度大于a点酸的总浓度 | |
| B. | c点溶液的导电性比b点强 | |
| C. | a点Kw的数值比c点溶液的Kw的数值大 | |
| D. | b点水电离产生的c(H+)比a点大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| 体系 | c(SO2) mol/L | c(O2) mol/L | c(SO3) mol/L | 浓度商 |
| (1) | 0.0600 | 0.400 | 2.000 | 不填 |
| (2) | 0.0960 | 0.300 | 0.500 | 不填 |
| (3) | 0.0862 | 0.263 | 1.020 | 不填 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除0族元素外,短周期元素的最高化合价在数值上都等于该元素所属族的族序数 | |
| B. | 在周期表里,主族元素所在的族序数等于原子核外电子数 | |
| C. | 副族元素没有非金属元素 | |
| D. | 元素的原子序数越大,其原子半径也越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑤⑥⑧ | B. | ③④⑦ | C. | ①③⑥ | D. | ②⑥⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com