
【题目】Ⅰ:报据下列有关图象,回答有关问题:
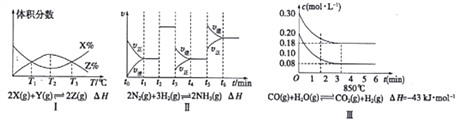
(1)由图I知,该反应的△H__________0(填“>”或“<”〉)
(2)由图Ⅱ知,反应在________时刻,NH3体枳分数最大(填t1~t2或t2~t3或t3~t4或t4~t5或t5~t6)
(3)图Ⅲ表示在10L容器、850℃时的反应,由图知,到4min时,反应放出的热量为___________。
Ⅱ: 25℃时,将体积为Va、pH=ɑ的某一元强酸与体积为Vb、pH=b的某一元强碱混合,且己知ɑ=0.56,
Va请完成下列各题。
(1)ɑ是否可以等于3 (填“是”或“否”)____________。
(2)若a+b=13,酸是盐酸,碱是KOH,现用盐酸滴定50.00mLKOH溶液,当滴定到溶液的pH=2时,消耗盐酸11.11mL。则b=___________。
(3)若己知酸是强酸,碱是强碱,酸和碱恰好中和,则ɑ的取值范围是____________。
【答案】 <0 t1-t2或t2-t3 51.6kJ 否 12 7/2
【解析】Ⅰ. (1). 由图Ⅰ知,反应在T1、T3处反应物和生成物的体积分数相等但反应不一定达到平衡,T2T3升高温度,反应物体积分数增大,生成物体积分数减小,平衡向逆反应方向移动,所以正反应是放热反应,△H<0,故答案为:<;
(2). 由图Ⅱ知,t2时刻正逆反应速率都增大且相等,改变的条件是加入催化剂,平衡不移动,t3时刻正逆反应速率都减小,且逆反应速率大于正反应速率,则改变的条件是减小压强,平衡向逆反应方向移动,t5时刻正逆反应速率都增大,且逆反应速率大于正反应速率,则改变的条件是升高温度,平衡向逆反应方向移动,所以反应在t1-t2或t2-t3时,NH3体积分数最大,故答案为:t1-t2或t2-t3;
(3). 该反应是一个放热反应,1molCO完全转化时放出43kJ能量,当转化(0.300.18)mol/L×10L=1.2molCO时放出51.6kJ的热量,故答案为:51.6kJ;
Ⅱ. (1).若a=3,则b=6,因25℃时,pH=7溶液呈中性,若pH=6则溶液呈酸性,但PH=b的是一元强碱,溶液只能呈碱性,即PH只能大于7,故a不能等于3,故答案是:否;
(2).若a+b=13,酸是盐酸,碱是KOH,则酸中c(H+)=10pHmolL1=10amolL1,碱中c(OH)=10pH14molL1=10b14molL1=10(a+1)molL1,pH=2时,c(H+)=102mol/L=(10amol/L×1.111×10210(a+1)mol/L×5×102)÷(1.111×102L+5×102L),解得,a=1,所以,b=12,故答案为:12;
(3). pH=b的强碱溶液呈碱性,则b>7,a=0.5b,则a>0.5×7=3.5,即a>7/2;pH=a的强酸,c(H+)=10amol/L,pH=b的强碱c(OH)=10b14mol/L,恰好中和,则有Va×10a=Vb×10b14,
可得: ![]() =10a+b14,Va,则10a+b14<1,a+b<14,又a=0.5b,则a+2a<14,3a<14,a<14/3,所以:7/2故答案为:7/2
=10a+b14,Va,则10a+b14<1,a+b<14,又a=0.5b,则a+2a<14,3a<14,a<14/3,所以:7/2故答案为:7/2


科目:高中化学 来源: 题型:
【题目】分子式为C7H16O的饱和一元醇的同分异构体有多种,在下列该醇的同分异构体中,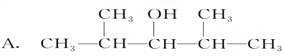
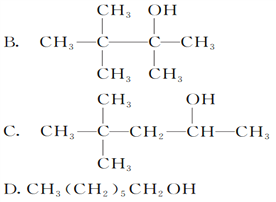
(1)可以发生消去反应,生成两种单烯烃的是________;
(2)可以发生催化氧化生成醛的是________;
(3)不能发生催化氧化的是________;
(4)能被催化氧化为酮的有________种;
(5)能使KMnO4酸性溶液褪色的有________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素原子序数与最外层电子数之间的关系图,下列说法中正确的是( ) 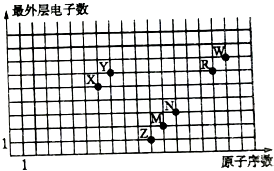
A.元素对应的离子半径:Z>M>R>W
B.简单氢化物的沸点:W>R>Y>X
C.气态氢化物的稳定性:X>Y>R>W
D.Z,X,R,W的最高价氧化物对应的水化物均能与N的单质反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于第三周期元素性质的说法正确的是( )
A. 镁单质能和冷水发生剧烈的反应 B. 碱性Mg(OH)2<Al(OH)3
C. 稳定性SiH4<HCl D. 金属性Na<Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族.C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子.
请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关):
(1)A~F六种元素,最高价氧化物的水化物显碱性的元素在周期表中的位置是;
(2)A、C、D三种元素组成的一种常见化合物是重要的工业产品,该化合物含有的化学键为;
(3)B与F两种元素形成的一种化合物分子,各原子均达8e﹣稳定结构,用电子式表示该化合物的形成过程;
(4)E的最高价氧化物的水化物可作为铅蓄电池的电解质溶液,写出该电池放电时的正极方程式:正极 .
(5)比较E、F的非金属性强弱:EF(填大于或小于).写出可以验证该结论的一个化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO2-、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验:下列说法正确的是( )
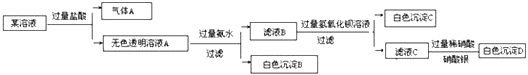
A. 原溶液中一定只存在AlO2-、CO32-、SO42-、Cl-四种离子
B. 气体A的化学式是CO2,其电子式为O::C::O
C. 原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+
D. 生成沉淀B的离子方程式为:Al3++3OH-=Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得70℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是( )
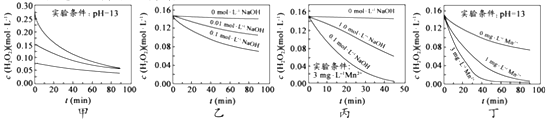
A. 图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B. 图乙表明,其他条件相同时,溶液PH 越小,H2O2分解速率越快
C. 图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D. 图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Cu﹣Zn原电池的装置示意图,下列叙述正确的是( ) 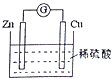
A.Zn片是正极
B.电池工作时,H+在铜片上得电子
C.电池工作时,电能转变为化学能,且锌片逐渐被消耗
D.电池工作时,电子从锌片通过硫酸溶液流向铜片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列碳原子的物质的量为1 mol的是( )
A. 0.012 kg C B. 0.012 kg12C
C. 0.012 kg13C D. 0.012 kg12C和13C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com