
分析 据CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,根据方程式中石灰石的质量进行计算;据产率=$\frac{实际产量}{理论产量}$×100%;据利用率=$\frac{实际用量}{投料}$×100%.
解答 解:m(CaCO3)=85%×10kg=8500g
CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑
100 g 22.4L
8500g 1904L
则:V(CO2)=1904L=1.904m3
答:能制得1.904m3CO2.
w=$\frac{实际产量}{理论产量}$×100%=$\frac{1.5{m}^{3}}{1.904{m}^{3}}$×100%=78.78%
答:产率是78.78%.
CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑
100 22.4
6696 1500
则:m(CaCO3)=6696g=6.696kg
w=$\frac{实际用量}{投料}$×100%=$\frac{6.696kg}{10.8kg}$×100%=62%
答:原料的利用率62%.
点评 正确书写碳酸钙高温煅烧的方程式是本题解题的关键,并注意L和m3之间的换算,本题题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | O |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑫ | ⑬ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
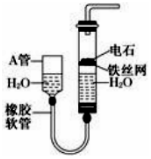 如图,图中的实验装置可用于制取乙炔.
如图,图中的实验装置可用于制取乙炔.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 太阳能电池的发展已经进入了第三代.第三代就是铜铟镓硒CIGS等化合物薄膜太阳能电池以及薄膜硅系太阳能电池.完成下列填空:
太阳能电池的发展已经进入了第三代.第三代就是铜铟镓硒CIGS等化合物薄膜太阳能电池以及薄膜硅系太阳能电池.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W与X形成的简单二元化合物的电子式为 | |
| B. | 短周期元素中Y的原子半径最大 | |
| C. | 工业上通过电解Y的氧化物制取Y的单质 | |
| D. | 最外层电子数等于其电子层数的金属与Z形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H11CI的有机物,分子结构中含2个甲基的同分异构体有4种 | |
| B. | CH3COOH与C2H518OH在浓硫酸作用下加热,反应生有机物分子的结构简式为CH3COOC2H5 | |
| C. | 三氯甲烷只有一种结构,不存在同分异构,证明甲烷是正四面体构型 | |
| D. | 煎炸食物的花生油和牛油都是可皂化的饱和醋类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+ 1s22s22p63s23p6 | B. | F 1s22s22p5 | ||
| C. | S2- 1s22s22p63s23p4 | D. | Ar 1s22s22p63s23p6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 5种固体物质A、B、C、D、E由表中不同的阴阳离子组成,它们均易溶于水.
5种固体物质A、B、C、D、E由表中不同的阴阳离子组成,它们均易溶于水.| 阳离子 | Na+ Al3+Fe3+ Cu2+、Ba2+ |
| 阴离子 | OH- Cl- CO32- NO3- SO4- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com