
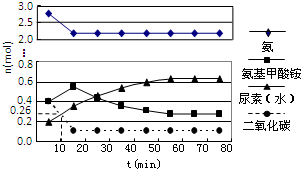
 尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应分为如下两步:
尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应分为如下两步:| 消耗量 |
| 起始量 |
| 1mol-0.26mol |
| 0.5L |
| 0.148mol/L |
| 10min |
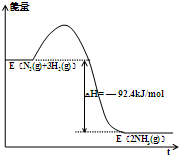
 ;
;| 2x |
| 4-2x |
| 3×0.20mol/L |
| 3mol/L |


科目:高中化学 来源: 题型:
| A、18gH2O含有10 NA个质子 |
| B、1mol己烷含有18NA个化学键 |
| C、22.4L氨水含有NA个NH3分子 |
| D、56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
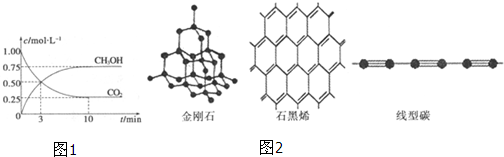
查看答案和解析>>
科目:高中化学 来源: 题型:
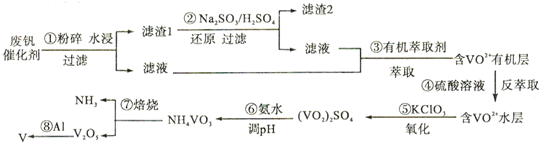
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、装置A中药品应为浓硫酸 |
| B、在B-C之间应增添盛有饱和NaHCO3溶液的洗气装置,以除去氯化氢气体 |
| C、为了测得C中生成的沉淀质量,需经过过滤、洗涤、干燥、称量等操作 |
| D、只要测定装置C在吸收CO2前后的质量差,也可以确定碳酸钙的质量分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
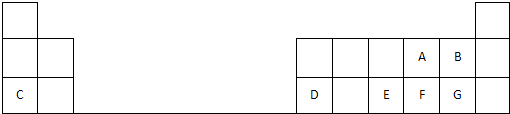
查看答案和解析>>
科目:高中化学 来源: 题型:
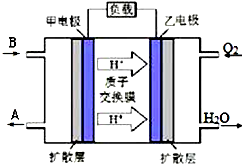 已知A、B、C、D是中学化学常见物质,它们在一定条件下有A+B→C+D的转化关系.
已知A、B、C、D是中学化学常见物质,它们在一定条件下有A+B→C+D的转化关系.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com