
| A. | 人类历史上使用最早的合金是青铜 | |
| B. | 目前世界上用量最大的合金是钢 | |
| C. | 改变原料的配比、改变生成合金的条件,可以得到具有不同性质的合金 | |
| D. | 一般合金的熔点高于它的各成分金属 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 相同 | |
| B. | 无法比较 | |
| C. | 依次为0.12mol/L、0.24mol/L、0.36mol/L | |
| D. | 依次为0.06mol/L、0.12mol/L、0.18mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2g | B. | 4g | C. | 8g | D. | 10g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LHF中含有的分子数目为NA | |
| B. | .1 L 0.1mol/L 的FeCl3溶液中,Fe3+的数目为0.1NA | |
| C. | .标准状况下,2.24LCl2溶于水,转移的电子数目为0.1NA | |
| D. | .5.6gFe在0.1molCl2中充分燃烧,转移的电子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
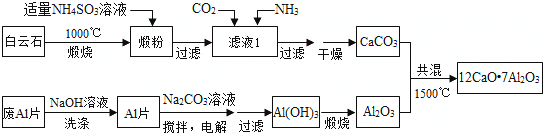
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
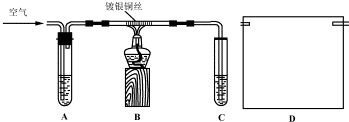
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| W | X | ||
| Y | Z |
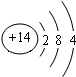
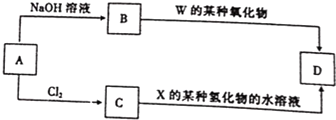
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com