
| A. | 分散质粒子不能透过滤纸 | B. | 具有丁达尔效应 | ||
| C. | 分散质很快就沉降下来 | D. | 所得分散系是溶液 |
分析 由“纳米技术”是指粒子直径在几纳米到几十米的材料,则分散到液体分散剂中,分散质的直径在1nm~100nm之间,以此来解答.
解答 解:分散系中分散质的直径在1nm~100nm之间的属于胶体分散系,由“纳米技术”是指粒子直径在几纳米到几十纳米的材料,则分散到液体分散剂中,分散质的直径在1nm~100nm之间,则该混合物属于胶体,所以所得混合物可能具有的性质是胶体的性质.
A.胶体的分散质粒子能透过滤纸,故A错误;
B.胶体能产生丁达尔效应,故B正确;
C.胶体较稳定,不会很快沉降,故C错误;
D.所得分散系是胶体,故D错误.
故选B.
点评 本题考查分散系的判断及胶体的性质,明确纳米材料的直径是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
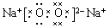 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH 溶液、浓H2SO4 | B. | 溴的四氯化碳溶液、浓H2SO4 | ||
| C. | 乙醇、浓H2SO4 | D. | 酸性高锰酸钾溶液、浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用饱和碳酸钠溶液除去乙酸乙醋中的乙酸和乙醇 | |
| B. | 用加人NaOH 溶液、分液的方法来分离甲苯和苯酚的混合液 | |
| C. | 用渗析的方法对蛋白质胶体进行提纯,以净化蛋白质胶体 | |
| D. | 用酸性高锰酸钾溶液除去乙烷中的乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
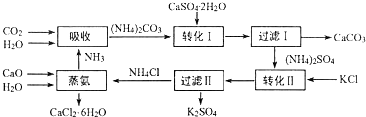
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
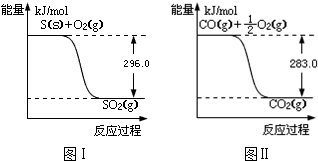
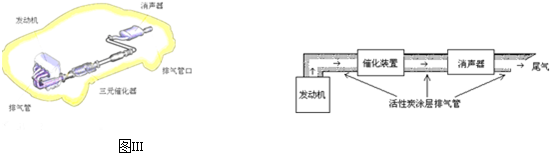
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com