
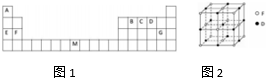
分析 由元素在周期表中的位置,可知A为H元素、B为碳元素、C为N元素、D为O元素、E为Na、F为Mg、G为Cl、M为Fe.
(1)Fe原子核外电子数为26,根据能量最低原理书写核外电子排布式;
同周期随原子序数增大,元素第一电离能呈增大趋势,N元素原子2p轨道为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的;
(2)化合物Fe(CO)3的熔点为-20℃,沸点为103℃,熔沸点比较低,符合分子晶体的性质;它在空气中燃烧生成红棕色氧化物,该氧化物为氧化铁,还生成二氧化碳;
(3)化合物COCl2的C原子形成3个σ键,没有孤对电子,价层电子对数为3;与COCl2具有相同空间构型的含氧酸根离子的中心原子连接3个O原子且没有孤对电子;
(4)根据均摊法计算晶胞中Mg原子、O原子数目,用阿伏伽德罗常数表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算该晶体的密度.
解答 解:由元素在周期表中的位置,可知A为H元素、B为碳元素、C为N元素、D为O元素、E为Na、F为Mg、G为Cl、M为Fe.
(1)Fe原子核外电子数为26,核外电子排布式为1s22s22p63s23p63d64s2;
同周期随原子序数增大,元素第一电离能呈增大趋势,N元素原子2p轨道为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的,故第一电离能N>O>C,
故答案为:1s22s22p63s23p63d64s2;N>O>C;
(2)化合物Fe(CO)3的熔点为-20℃,沸点为103℃,熔沸点比较低,属于分子晶体,它在空气中燃烧生成红棕色氧化物,该氧化物为氧化铁,还生成二氧化碳,反应方程式为:4Fe(CO)3+9O2$\frac{\underline{\;加热\;}}{\;}$2Fe2O3+12CO2,
故答案为:分子;4Fe(CO)3+9O2$\frac{\underline{\;加热\;}}{\;}$2Fe2O3+12CO2;
(3)化合物COCl2的C原子形成3个σ键,没有孤对电子,价层电子对数为3,空间结构为平面三角形,与COCl2具有相同空间构型的含氧酸根离子的中心原子连接3个O原子且没有孤对电子,为NO3-、CO32-等,
故答案为:平面三角形;NO3-、CO32-等;
(4)晶胞中Mg原子数目为6×$\frac{1}{2}$+8×$\frac{1}{8}$=4、O原子数目=1+12×$\frac{1}{4}$=4,则晶胞质量为4×$\frac{24+16}{{N}_{A}}$g,晶胞参数(即边长)为amm,阿伏伽德罗常数为NA,该晶体的密度为 4×$\frac{24+16}{{N}_{A}}$g÷(0.1a cm)3=$\frac{1.6×1{0}^{5}}{{a}^{3}{N}_{A}}$g•cm-3,
故答案为:$\frac{1.6×1{0}^{5}}{{a}^{3}{N}_{A}}$.
点评 本题是对物质结构与性质的考查,涉及元素周期表、核外电子排布、电离能、晶体类型与性质、空间构型判断、晶胞计算等,注意同周期主族元素中第一电离能异常情况,需要学生具备扎实的基础.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:选择题
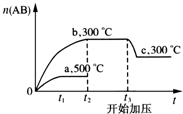 可逆反应:A2(?)+B2(?)?2AB(?),当温度和压强改变时n(AB)的变化如图,下列叙述正确的是( )
可逆反应:A2(?)+B2(?)?2AB(?),当温度和压强改变时n(AB)的变化如图,下列叙述正确的是( )| A. | A2、B2及AB均为气体,△H<0 | |
| B. | AB为气体,A2、B2至少有一种为非气体,△H<0 | |
| C. | AB为气体,A2、B2有一种为非气体,△H>0 | |
| D. | AB为固体,A2、B2有一种为非气体,△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷分子中3个碳原子一定在同一条直线上 | |
| B. | 甲苯分子中7个碳原子都在同一平面上 | |
| C. | 3-甲基-1-丁炔分子中所有碳原子都在同一平面上 | |
| D. | 2-丁烯分子中4个碳原子有可能在同一条直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮气的化学性质比氧气稳定 | |
| B. | 常温、常压下,溴呈液态,碘呈固态 | |
| C. | 稀有气体一般很难发生化学反应 | |
| D. | 相同状态下,氯气的密度比空气的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
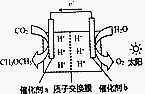 模拟植物的光合作用,利用太阳能将H2O和CO2化合生成二甲醚(CH3OCH3),装置如图所示,下列说法错误的是( )
模拟植物的光合作用,利用太阳能将H2O和CO2化合生成二甲醚(CH3OCH3),装置如图所示,下列说法错误的是( )| A. | H+由交换膜右侧向左侧迁移 | |
| B. | 催化剂a表面发生的反应是2CO2+12e-+12H+═CH3OCH3+3H2O | |
| C. | 该过程是太阳能转化为化学能的过程 | |
| D. | 消耗CO2与生成O2体积比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

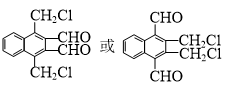 .
.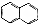 )的衍生物,且取代基都在同一个苯环上;
)的衍生物,且取代基都在同一个苯环上;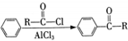 (R为烃基).根据已有知识并结合相关信息,写出以ClCH2CH2CH2Cl和
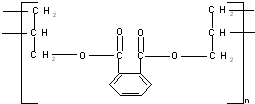
(R为烃基).根据已有知识并结合相关信息,写出以ClCH2CH2CH2Cl和 为原料制备
为原料制备 的合成路线流程图(无机试剂可任选).合成路线流程图示例如图所示:
的合成路线流程图(无机试剂可任选).合成路线流程图示例如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
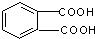 ⑤邻苯二甲酸甲酯
⑤邻苯二甲酸甲酯 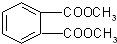
| A. | ①② | B. | ③④ | C. | ②④ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1-5△H2-12△H3 | B. | 2△H1-5△H2-12△H3 | C. | 12△H3-5△H2-2△H1 | D. | 12△H3+5△H2-2△H1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的简单离子半径小于W的简单离子半径 | |
| B. | W、X形成的化合物为离子化合物 | |
| C. | X的最高价氧化物对应的水化物的酸性比W的强 | |
| D. | Z的气态简单氢化物的稳定性比X的强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com