
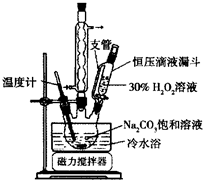
 2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.
2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.分析 (1)球形冷凝管可使液体冷凝回流;
(2)冷水浴作用是防止温度过高,过氧化氢分解;
(3)加入适量NaCl固体,发生盐析;
(4)2Na2CO3•3H2O2极易分解,生成碳酸钠、氧气、水;
(5)高锰酸钾标准溶液为紫色,与过氧化氢发生氧化还原反应;
(6)Mn元素的化合价降低,过氧化氢中O元素化合价升高,且碳酸根离子与酸反应生成二氧化碳;
(7)活性氧含量计算公式:Q%=$\frac{40cV}{m}$×100%,以此计算;
(8)方案中可测定过氧化氢分解生成的氧气,或测定碳酸根离子转化生成的沉淀或气体来测定产品中2Na2CO3•3H2O2的质量分数.
解答 解:(1)装置中球形冷凝管的作用是起冷凝回流的作用,
故答案为:冷凝回流;
(2)过氧化氢不稳定,则使用冷水浴的作用是防止温度过高,H2O2分解,
故答案为:防止温度过高,H2O2分解;
(3)加入适量NaCl固体,降低产品的溶解度(盐析作用)或便于析出晶体,
故答案为:降低产品的溶解度(盐析作用)或便于析出晶体;
(4)2Na2CO3•3H2O2极易分解,生成碳酸钠、氧气、水,反应方程式为:2(2Na2CO3•3H2O2)═4Na2CO3+6H2O+3O2↑,
故答案为:2(2Na2CO3•3H2O2)═4Na2CO3+6H2O+3O2↑;
(5)高锰酸钾标准溶液为紫色,能与过氧化氢发生氧化还原反应,高锰酸钾标准溶液滴定2Na2CO3•3H2O2,则滴定终点的判断依据为溶液由无色呈紫色且30s内不褪色,
故答案为:溶液由无色呈紫色且30s内不褪色;
(6)Mn元素的化合价降低,过氧化氢中O元素化合价升高,且碳酸根离子与酸反应生成二氧化碳,则滴定过程中涉及的化学方程式为5(2Na2CO3•3H2O2)+6KMnO4+19H2SO4=3K2SO4+6MnSO4+10Na2SO4+10CO2↑+15O2↑+34H2O,
故答案为:5(2Na2CO3•3H2O2)+6KMnO4+19H2SO4=3K2SO4+6MnSO4+10Na2SO4+10CO2↑+15O2↑+34H2O;
(7)0.0200mol/L高锰酸钾标准溶液消耗的体积为32.70mL,试样0.2000g,活性氧含量为Q%=$\frac{40cV}{m}$×100%=$\frac{40×0.0200mol/L×0.03270L}{0.2000g}$×100%=13.08%,
故答案为:13.08%;
(8)方案中可测定过氧化氢分解生成的氧气,或测定碳酸根离子转化生成的沉淀(或气体体积)质量测定产品中2Na2CO3•3H2O2的质量分数,则方案二为将试样与足量的氯化钡(或氯化钙等)溶液反应后,过滤,干燥所得沉淀,称量沉淀的质量(或试样与足量稀硫酸反应后,经除杂干燥后,测二氧化碳的体积,进行计算),
故答案为:将试样与足量的氯化钡(或氯化钙等)溶液反应后,过滤,干燥所得沉淀,称量沉淀的质量(或试样与足量稀硫酸反应后,经除杂干燥后,测二氧化碳的体积,进行计算).
点评 本题考查制备实验方案的设计,为高频考点,题目难度中等,把握实验基本操作、实验技能及测定原理、发生的反应等为解答的关键,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
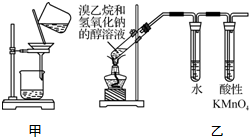
| A. | 用玻璃棒蘸取氯水点在干燥的pH试纸上,测定该溶液的pH | |
| B. | 称取4.0 g NaOH,放入100 mL容量瓶中,加水稀释,配制1.0 mol•L-1的NaOH溶液 | |
| C. | 用甲装置分离Cl2与KI溶液反应生成的碘 | |
| D. | 用乙装置检验溴乙烷与NaOH醇溶液共热产生乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
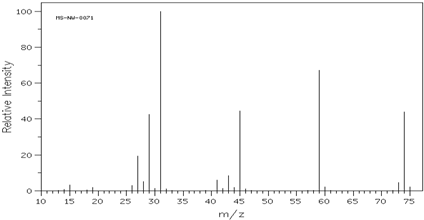
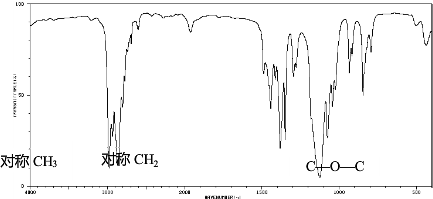
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 600 | 700 |
| 平衡常数 | K1 | K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

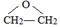 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油和自来水(蒸馏) | B. | 水溶液中的食盐和碘(分液) | ||
| C. | CaCO3和CaCl2(溶解、过滤、蒸发) | D. | 泥水中的不溶性泥沙(萃取) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com