
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO42-、OH- |
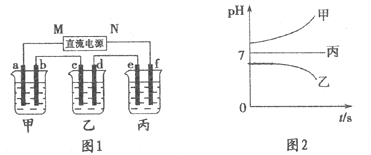
分析 测得乙中c电极质量增加了16g,由表可知乙中含有Cu2+,结合离子的共存可知,B为CuSO4,丙中pH不变,则C为硫酸钠或硫酸钾,甲中pH增大,则A为KOH或NaOH;
(1)c电极析出Cu,所以c为阴极,则M为负极;b为阳极,电极上是氢氧根离子失电子生成氧气;
(2)根据生成的Cu的量求出转移的电子的物质的量,再根据电子守恒求出e上生成的气体的量;
(3)乙烧杯中电解的是硫酸铜溶液;
(4)溶液中的水也可以被电解;
(5)根据电解质在电解以后要想复原,符合的原则是:出什么加什么,丙为硫酸钠或硝酸钾溶液,实质上为电解水结合电路上电子守恒计算.
解答 解:测得乙中c电极质量增加了16g,由表可知乙中含有Cu2+,结合离子的共存可知,B为CuSO4,丙中pH不变,则C为硫酸钠或硫酸钾,甲中pH增大,则A为KOH或NaOH;
(1)c电极析出Cu,由铜离子在阴极得电子生成Cu可知c为阴极,则M为负极,N为正极;b与正极相连,则b为阳极,所以b电极上是氢氧根离子失电子生成氧气,其电极反应式为:4OH--4e-=2H2O+O2↑;
故答案为:负;4OH--4e-=2H2O+O2↑;
(2)e与电源负极相连为阴极,则e电极上是氢离子得电子生成氢气,已知n(Cu)=$\frac{16g}{64g/mol}$=0.25mol,由Cu~2e-~H2↑可知生成标况下氢气的体积为0.25mol×22.4L/mol=5.6L,故答案为:5.6L;
(3)乙烧杯中为惰性电极电解硫酸铜溶液,总反应为2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,故答案为:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4;
(4)如果电解过程中CuSO4溶液中的金属离子全部析出,此时溶液变成硫酸溶液,继续通电,溶液中电解的是水;
故答案为:能,因为CuSO4溶液已转变为H2SO4溶液,反应变为电解水;
(5)丙为硫酸钠或硫酸钾溶液,实质上为电解水,c电极析出Cu,质量增加了16g级0.25mol,转移电子0.5mol,根据2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,消耗水的物质的量为0.25mol,质量为0.25mol×18g/mol=4.5g,故答案为:加入4.5gH2O.
点评 本题考查了电解原理,明确发生的电极反应、电解反应及图象的分析是解答本题的关键,注意利用乙推出各物质及电源的正负极是解答的突破口,题目难度中等.


科目:高中化学 来源: 题型:解答题
 铁是人类使用最广泛的金属.
铁是人类使用最广泛的金属.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
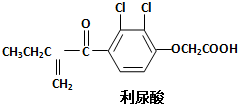 反兴奋剂是体育赛事关注的热点,利尿酸是一种常见的兴奋剂,其分子结构如下:关于利尿酸的说法中,正确的是( )
反兴奋剂是体育赛事关注的热点,利尿酸是一种常见的兴奋剂,其分子结构如下:关于利尿酸的说法中,正确的是( )| A. | 它的分子式是C13H11O4Cl2 | |
| B. | 它不能使酸性高锰酸钾溶液褪色 | |
| C. | 它不能与饱和碳酸钠溶液反应放出CO2 | |
| D. | 它能发生取代反应、加成反应和酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 同主族元素从上到下,元素原子得电子能力逐渐减弱,表现在氢化物的稳定性逐渐增强 | |
| B. | 除稀有气体元素外,第三周期元素的原子半径不一定比第二周期元素的原子半径大 | |
| C. | 化学反应的过程中一定伴随着热量的变化 | |
| D. | 在主族元素中,最外层电子数少的元素原于一定比最外层电子数多的元素原子失电子能力强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、纤维素、蛋白质的水解产物相同,都可以用来酿酒 | |
| B. | 油脂水解产物之一的甘油与乙醇含有相同的官能团 | |
| C. | 乙醇与乙醛互为同分异构体,乙醇可由乙烯通过加成反应制取 | |
| D. | 通过石油的裂化可得到乙烯,煤的干馏可得到煤焦油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 (“→”表示一步完成)关系相互转化的是( )
(“→”表示一步完成)关系相互转化的是( )| 选项 | A | B | C | D |
| a | Fe | H2SO4 | Al(OH)3 | HNO3 |
| b | FeCl3 | SO2 | Na[Al(OH)4] | NO |
| c | FeCl2 | SO3 | Al2O3 | NO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com