
室温下将浓度相同的NaOH和HCl溶液以3:2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为()
A. 0.01mol•L﹣1 B. 0.017mol•L﹣1 C. 0.05mol•L﹣1 D. 0.50mol•L﹣1
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
下列行为中符合安全要求的是()
A. 进入煤矿井时,用火把照明
B. 在开阔广场燃放烟花爆竹
C. 用点燃的火柴检验液化气钢瓶是否漏气
D. 进入下水道时,应用蜡烛照明
查看答案和解析>>
科目:高中化学 来源: 题型:
在溶液中能大量共存的离子组是( )
A. Na+、OH﹣、HCO3﹣ B. NH4+、NO3﹣、OH﹣
C. H+、K+、CO32﹣、 D. Ba2+、OH﹣、C1﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)将下列离子Na+、K+、Cu2+、H+、NO3﹣、Cl﹣、CO32﹣、OH﹣,按可能大量共存于同一溶液的情况,则分成A、B两组,而且每组中均含两种阳离子和两种阴离子,则A组 ,B组 .
用同浓度的AgNO3溶液分别与同浓度等体积的NaCl、MgCl2、AlCl3溶液反应,所用AgNO3溶液的体积比为 ;如用同浓度等体积的AgNO3溶液分别与等浓度的NaCl、MgCl2、AlCl3溶液反应,所用三种溶液的体积比为 .
(3)向一定量的Ba(OH)2溶液中逐滴加入稀硫酸,直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)近似的用下图中的曲线 表示.
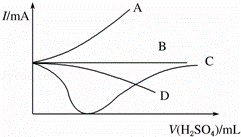
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与社会、生活密切相关,对下列现象或事实的解释正确的是()
选项 现象或事实 解释
A 用热的烧碱溶液洗去油污 Na2CO3可直接与油污反应
B 漂白粉在空气中久置变质 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3
C 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 K2CO3与NH4Cl反应生成氨气会降低肥效
D FeCl3溶液可用于铜质印刷线路板制作 FeCl3能从含Cu2+的溶液中置换出铜
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述正确的是()
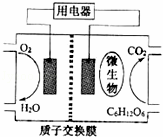
A. 该电池能够在高温下工作
B. 电池的负极反应为:C6H12O6+6H2O﹣24e﹣=6CO2↑+24H+
C. 放电过程中,H+从正极区向负极区迁移
D. 在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体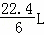
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,杠杆AB两端分别用导线挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其保持平衡,然后小心地向盛水的水槽中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是()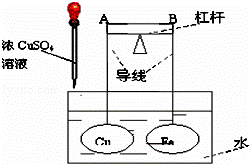
A. 杠杆为导体或绝缘体时,均为A端高B端低
B. 杠杆为导体或绝缘体时,均为A端低B端高
C. 当杠杆为导体时,A端低B端高;杠杆为绝缘体时,A端高B端低
D. 当杠杆为导体时,A端高B端低;杠杆为绝缘体时,A端低B端高
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾是一种高效绿色水处理剂,其工业制备的反应原理为2Fe(OH)3+3KClO+4KOH═2K2FeO4+3KCl+5H2O,下列说法正确的是()
A. 制备高铁酸钾用ClO﹣做还原剂
B. 制备高铁酸钾时1 mol Fe(OH)3得到3 mol 电子
C. 高铁酸钾中铁的化合价为+7
D. 用高铁酸钾处理水时,其还原产物能水解产生具有强吸附能力的胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,可制作燃料电池.
(1)已知:①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g)△H1=﹣1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=﹣566.0kJ/mol
③H2O(g)=H2O(1)△H3=﹣44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: .
(2)生产甲醇的原料CO和H2来源于:CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H>0
①一定条件下CH4的平衡转化率与温度、压强的关系如图a.则Tl T2(填“<”、“>”、“=”,下同);A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为 .
②100℃时,将1mol CH4和2mol H2O通入容积为1L的定容密封容器中,发生反应,能说明该反应已经达到平衡状态的是 .
a.容器内气体密度恒定
b.单位时间内消耗0.1mol CH4同时生成0.3mol H2
c.容器的压强恒定
d.3v正(CH4)=v逆(H2)
如果达到平衡时CH4的转化率为0.5,则100℃时该反应的平衡常数K=2.25.
(3)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图b所示的电池装置,则该电池负极的电极反应式为
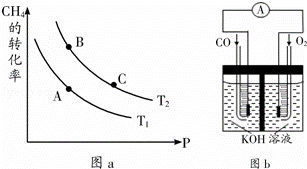
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com