
| A. | Na2S溶液显碱性:S2-+2H2O?H2S+2OH- | |
| B. | 用排饱和食盐水法收集Cl2:Cl2+H2O?H++Cl-+HClO | |
| C. | 草酸溶液使高锰酸钾酸性溶液褪色:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O | |
| D. | 向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2O?Al(OH)3(胶体)+3H+ |
分析 A.硫离子为多元弱酸根离子,分步水解,以第一步为主;
B.氯气与水反应生成氯化氢和次氯酸;
C.草酸具有还原性能够被酸性的高锰酸钾氧化;
D.铝离子为弱碱阳离子部分水解生成氢氧化铝胶体和氢离子.
解答 解:A.Na2S溶液显碱性,离子方程式:S2-+H2O?HS-+OH-,故A错误;
B.用排饱和食盐水法收集Cl2,离子方程式:Cl2+H2O?H++Cl-+HClO,故B正确;
C.草酸溶液使高锰酸钾酸性溶液褪色,离子方程式:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,故C正确;
D.向污水中投放明矾,生成能凝聚悬浮物的胶体,离子方程式:Al3++3H2O?Al(OH)3(胶体)+3H+,故D正确;
故选:A.
点评 本题考查了离子方程式的书写,明确发生的化学反应及离子反应方程式书写的方法、注意掌握判断离子方程式正误的常用方法,注意多元弱酸根离子分步水解,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 玻璃容器可长期盛放各种酸 | B. | 浓氨水可检验氯气管道泄漏 | ||
| C. | 浓硫酸可刻蚀石英制艺术品 | D. | 84消毒液的有效成分是NaClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

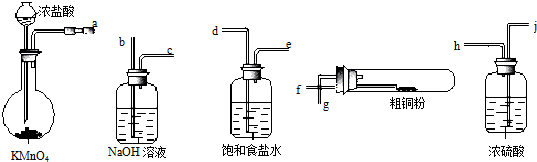
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
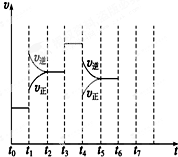 在一密闭容器中发生反应N2+3H22NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
在一密闭容器中发生反应N2+3H22NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
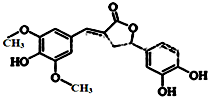
| A. | 分子中含有三种官能团 | |
| B. | 1 mol 该化合物最多能与6 mol NaOH 反应 | |
| C. | 1 mol 该化合物最多能与含4 molBr2的浓溴水反应 | |
| D. | 既能与FeCl3发生显色反应,也能和NaHCO3反应放出CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
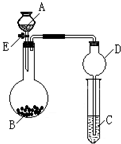 某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
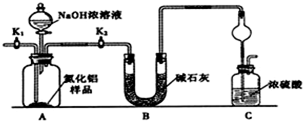
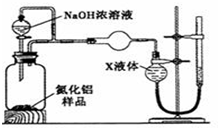
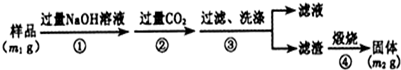
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com