

| A. | A-B之前 | B. | B-C间 | C. | C-D间 | D. | D-E间 |
分析 铁钉主要成分为生铁,含有碳,与浓硫酸反应时可生成二氧化硫、二氧化碳,随着反应的进行,硫酸浓度降低,稀硫酸与铁反应生成氢气,则Q为二氧化碳,检验二氧化碳,应排除二氧化硫的影响,以此解答该题.
解答 解:在加热时,铁钉中不仅铁和浓硫酸反应,碳也和浓硫酸反应生成生成二氧化硫、二氧化碳和水,A用于检验二氧化硫,B用于除去二氧化硫,二氧化硫能使品红溶液褪色,所以C可以检验B中是否完全除去二氧化硫,
Q为二氧化碳,二氧化碳和二氧化硫都能使澄清石灰水变浑浊,应在出去二氧化硫之后检验二氧化碳,则需在装置中添加M于C-D间,用石灰水检验,
故选C.
点评 本题考查了浓硫酸的性质、实验方案的设计与评价,题目难度中等,注意掌握性质实验方案设计的原则及评价方法,明确常见气体的性质及检验方法,难度不大.


 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:选择题
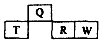 ( )
( )| A. | W的氢化物比R的氢化物稳定 | |
| B. | T的最高价氧化物水化物可能为强碱 | |
| C. | Q的原子半径比T的小 | |
| D. | W和Q的原子序数相差10 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 少量SO2气体通入NaClO溶液中:SO2+H2O+2ClO-=2HClO+SO32- | |
| B. | 碳酸钙中滴入醋酸溶液:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ | |
| C. | 碳酸氢镁溶液中加入过量的澄清石灰水:Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+MgCO3↓+2H2O | |
| D. | 硫酸亚铁溶液中加过氧化氢溶液:2Fe2++2H++H2O2=2Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
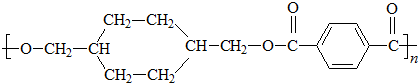
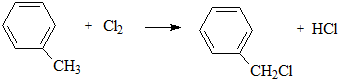
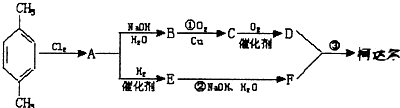
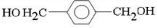 、D
、D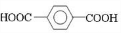 、E
、E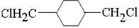 ;
;
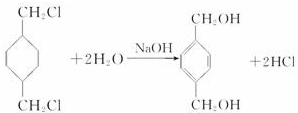 ;
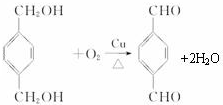
; +
+ $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$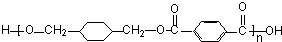 +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③⑤ | C. | ②④⑥ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
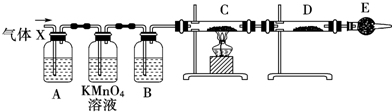
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
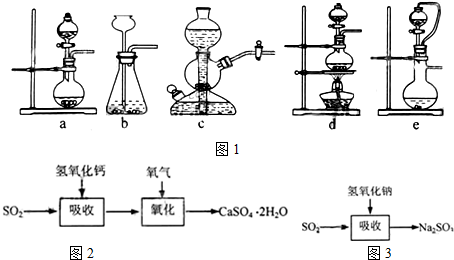
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
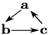 (“→”表示反应一步完成)关系转化的是( )
(“→”表示反应一步完成)关系转化的是( )| 选项 | a | b | c |
| A | NO | NO2 | HNO3 |
| B | SiO2 | Na2SiO3 | H2SiO3 |
| C | Al | NaAlO2 | Al(OH)3 |
| D | MgCl2 | Mg(OH)2 | MgO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com