
【题目】LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6。其流程如下:

已知:HCl的沸点是-85.0℃,HF的沸点是19.5℃。
(1)第①步反应中无水HF的作用是________、__________。反应设备不能用玻璃材质的原因是______________(用化学方程式表示)。无水HF有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的____________溶液冲洗。
(2)该流程需在无水条件下进行,第③步反应中PF5极易水解,其产物为两种酸,写出PF5水解的化学方程式:________________。
(3)第④步分离采用的方法是_____________;第⑤步分离尾气中HF、HC1采用的方法是____________。
(4)LiPF6产品中通常混有少量LiF。取样品wg。测得Li的物质的量为nmol,则该样品中LiPF6的物质的量为__________mol(用含有w、n的代数式表示)。
【答案】 反应物 溶剂 SiO2+4HF=SiF4↑+2H2O NaHCO3 PF5+4H2O=H3PO4+5HF 过滤 冷凝 ![]()
【解析】
(1)第①步反应中无水HF的作用是反应物、溶剂。反应设备不能用玻璃材质的原因是SiO2+4HF=SiF4↑+2H2O。无水HF有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的NaHCO3溶液冲洗。
(2)PF5水解产生的两种酸是氢氟酸和磷酸,水解的化学方程式:PF5+3H2O=H3PO4+5HF。
(3)第④步分离有滤液产生,所以采用的方法是过滤;HF、HCl的沸点差别较大,所以第⑤步分离尾气中HF、HCl采用的方法是冷凝。
(4)将LiPF6看作LiFPF5,样品wg含有LiF的物质的量为nmol,LiF的质量为26ng,含有PF5的质量为wg-26ng,PF5的物质的量为![]() mol,所以该样品中LiPF6的物质的量等于PF5的物质的量为
mol,所以该样品中LiPF6的物质的量等于PF5的物质的量为![]() mol。
mol。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】下列解释实验过程或事实的反应方程式不正确的是
A. 熔融烧碱时,不能使用普通石英坩埚:SiO2+2NaOH![]() Na2SiO3+H2O
Na2SiO3+H2O
B. 在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+ H2O2+2H+= I2+O2↑+2H2O
C. 红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层:3Fe+ 4H2O(g)![]() Fe3O4+4H2
Fe3O4+4H2
D. “84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用放出氯气:ClO-+ Cl-+ 2H+= Cl2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是NaCl、MgSO4的溶解度曲线.下列说法正确的是( ) 
A.只有在t1℃时,NaCl和MgSO4的溶解度才相等
B.t1℃~t2℃,MgSO4的溶解度随温度升高而减小
C.在t2℃时,MgSO4饱和溶液的溶质质量分数最大
D.把MgSO4饱和溶液的温度从t3℃降至t2℃时,有晶体析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的CO2和NH3 相比,下列说法不正确的是( )
A.常温常压下,密度之比为44:17B.分子数之比为1:1
C.原子数之比为1:1D.质量之比为44:17
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与 Y同族,Z 与X 形成的离子化合物的水溶液呈中性。下列说法正确的是
A. 简单离子半径:W<X<Z
B. W与X形成的化合物溶于水后溶液呈碱性
C. 气态氢化物的热稳定性:W<Y
D. 最高价氧化物的水化物的酸性:Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. Na2O2、NaClO中所含化学键类型完全相同
B. 只有活泼金属与活泼非金属元素之间才能形成离子键
C. D2O和T2O含有同种元素
D. 氯气与NaOH反应的过程中,同时又离子键、极性键和非极性键的断裂和形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F六种短周期主族元素,原子序数依次增大.已知A的气态氢化物能与其最高价氧化物的水化物反应,B原子最外层电子数是电子层数的3倍,C+和D3+离子的电子层结构相同,B与E属于同一主族.请回答下列问题:
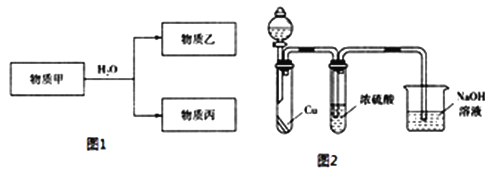
(1)E在元素周期表中的位置是________
(2)上述元素形成的简单离子中,半径最小的是________(填离子符号).
(3)由上述元素中的一种或几种组成的物质甲可以发生如图1反应:
①若乙具有漂白性,则乙的电子式为________.
②若丙的水溶液是强碱性溶液,则甲为______________(填化学式).
③若乙为二元弱酸,丙既能溶于强酸、又能溶于强碱,则乙的名称为________;用电离方程式表示丙既能溶于强酸、又能溶于强碱的原因________.
④乙遇空气变为红棕色,有同学认为“浓硫酸可以干燥气体甲”,为验证其观点是否正确.用如图2装置进行实验时,分液漏斗中应加入________(填试剂名称).实验过程中,浓硫酸中未发现有气体逸出,且溶液变为红棕色,由此得出的结论是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.1molH2O的质量为18g/mol
B.CH4的摩尔质量为16g
C.3.01×1023个SO2分子的质量为32g
D.标准状况下,1mol任何物质体积均为22.4L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com