
 某校课外小组为测定某Na2CO3和NaHCO3混合物中Na2CO3的质量分数,甲、乙两组同学分别进行了下列相关实验.
某校课外小组为测定某Na2CO3和NaHCO3混合物中Na2CO3的质量分数,甲、乙两组同学分别进行了下列相关实验.分析 方案Ⅰ.(1)根据过滤操作考虑所需仪器;过滤操用到的仪器有铁架台、漏斗、烧杯、玻璃棒等;其中属于玻璃仪器有:漏斗、烧杯、玻璃棒;
(2)沉淀n为碳酸钡,根据碳守恒,碳酸钠的物质的量和碳酸钡相等,进而计算质量分数;
方案Ⅱ.碳酸钠和碳酸氢钠与稀硫酸反应生成二氧化碳,把除去水蒸气的二氧化碳被碱石灰吸收,通过碱石灰的增重求得二氧化碳的质量,根据二氧化碳的质量和样品质量求得碳酸钠的物质的量,进而求得质量分数.A装置:Na2CO3和NaHCO3混合物和硫酸反应生成二氧化碳,B装置:干燥二氧化碳,C吸收二氧化碳,D装置:防止空气中的二氧化碳和水蒸气进入装置C影响测定结果.
(3)装置B是除去生成二氧化碳气中的水蒸气,利用浓硫酸吸收;盐酸易挥发,生成的二氧化碳中含有氯化氢;
(4)等质量碳酸钠和碳酸氢钠与硫酸反应,碳酸氢钠产生二氧化碳多;
(5)空气中的水蒸气和二氧化碳会被碱石灰吸收;
(6)该方案关键是要获得产生的CO2的质量,故应保证产生的二氧化碳完全被吸收,而空气中二氧化碳不能被吸收.
解答 解:方案Ⅰ.(1)过滤中用到的仪器有:铁架台、玻璃棒、烧杯、漏斗等,其中用到的三种玻璃仪器是漏斗、烧杯、玻璃棒;烧杯用来盛放液体,漏斗用于过滤,玻璃棒用来引流和搅拌,
故答案为:玻璃棒;
(2)沉淀n为碳酸钡,物质的量$\frac{ng}{197g/mol}$=$\frac{n}{197}$mol,根据碳守恒,碳酸钠的物质的量和碳酸钡相等,故碳酸钠的物质的量为:$\frac{n}{197}$mol,碳酸钠的质量分数为:$\frac{\frac{n}{197}mol×106g/mol}{mg}$×100%=$\frac{106n}{197m}$×100%,
故答案为:$\frac{106n}{197m}$×100%;
方案Ⅱ.(3)装置B的作用是把气体中的水蒸气除去,故用浓硫酸来除去水蒸气;分液漏斗中如果用盐酸代替硫酸,盐酸易挥发,这样制得二氧化碳气体中含氯化氢,浓硫酸不能吸收氯化氢,则氯化氢被碱石灰吸收,导致测到二氧化碳质量偏高,等质量碳酸钠和碳酸氢钠,碳酸氢钠产生二氧化碳多,则会导致碳酸氢钠偏多,碳酸钠偏小;
故答案为:浓硫酸;不能;
(4)等质量碳酸钠和碳酸氢钠,碳酸氢钠产生二氧化碳多,故若样品中碳酸钠的质量分数越大,则产生二氧化碳越少,则实验中干燥管C在充分吸收气体前后的质量差就越小,
故答案为:越小;
(5)空气中的水蒸气和二氧化碳会被碱石灰吸收,故D的作用是吸收空气中的水蒸气和二氧化碳,以确保C装置中质量增加量的准确性;
故答案为:吸收空气中的水蒸气和二氧化碳,以确保C装置中质量增加量的准确性;
(6)该方案关键是要获得产生的CO2的质量,实验前容器内含有空气,空气中含有二氧化碳,会影响生成的二氧化碳的量,反应后装置中容器内含有二氧化碳,不能被C中碱石灰完全吸收,导致测定结果有较大误差,所以反应前后都要通入N2,反应后通入N2的目的是:排尽装置内的空气,将生成的二氧化碳从容器内排出,被C装置中碱石灰吸收,
故答案为:将B、C装置中的残留二氧化碳全部驱入D装置的碱石灰中减小实验误差.
点评 本题考查碳酸钠含量的测定实验,为高频考点,把握实验装置的作用及实验目的为解答的关键,侧重分析、计算及实验能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 在粗盐提纯中,当加热到蒸发皿中有较多固体析出,残留少量液体时,停止加热,用余热将液体蒸干 | |
| B. | 当振荡分液漏斗中的混合溶液时,须用一只手压住分液漏斗的玻璃塞,另一只手握住旋塞,将分液漏斗倒转过来,用力振荡 | |
| C. | 粗盐提纯得到精盐的过程一定需要两次过滤操作 | |
| D. | 实验过程中若皮肤不慎沾上少量碱液,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
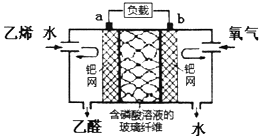
| A. | 该电化学装置是电解池 | |
| B. | a极反应式为:CH2=CH2-2e-+H2O=CH3CHO+2H+ | |
| C. | 氧气在b极被氧化 | |
| D. | 电子移动方向:电极a→负载→电极b→磷酸溶液→电极a |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
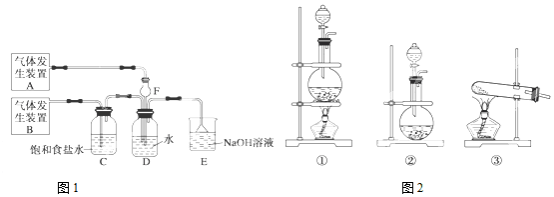
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
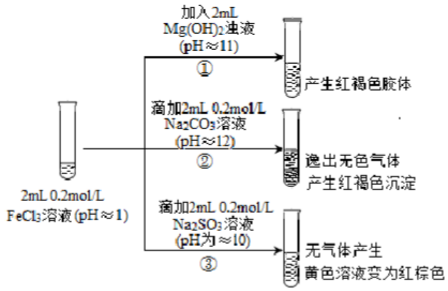
| 实验操作及现象 | ④向2mL0.2mol/L FeCl3溶液中滴入2mL1mol/LNaF溶液.溶液变无色 |
| ⑤向2mL0.2mol/L FeCl3溶液中滴入2mL蒸馏水,溶液颜色变浅 |
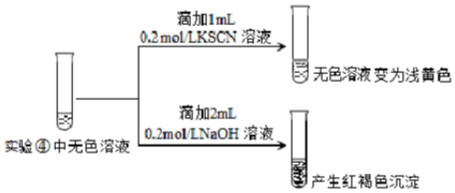
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用该溶液滴定未知浓度的NaOH溶液,用甲堪橙作指示剂 | |
| B. | 加水稀释时,$\frac{c(O{H}^{-})}{c({H}_{3}B{O}_{3})}$减小 | |
| C. | 常温下,加入等体积pH=9的NaOH溶液后,溶液呈中性 | |
| D. | 常温下,向该溶液滴加NaOH溶液至pH=7时,c(Na+)=c([B(OH)4]-)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C8H10含苯环的烃的同分异构体有3种 | |
| B. | 葡萄糖、蔗糖、淀粉在一定条件下都可发生水解反应 | |
| C. | C4H8→C4H7Cl的转化是取代反应 | |
| D. | 丙烯酸(CH2═CHCOOH)和山梨酸(CH3═CHCH═CHCOOH)互为同系物 |
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三上10月月考化学试卷(解析版) 题型:实验题
I.下面是中学化学中常用玻璃仪器组成的实验装置图(根据需要可在其中加入液体或固体)。

请回答下列问题:
(1)能用作干燥氨气的装置有___________(填字母);
(2)既能用于收集氯气又能用于收集一氧化氮气体的装置有___________(填字母);
(3)在氯气和铁反应实验中,能添加在制氯气和反应装置之间以除去氯气中氯化氢等杂质气体的装置有___________(填字母);
(4)若用C装置作二氧化硫与烧杯中氢氧化钠溶液反应的实验,则其中广口瓶的作用是__________。
II.我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:

(1) 沉淀池中发生的化学反应方程式是______________________。
(2) 写出上述流程中X物质的分子式___________。
(3)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加___________。
(4) 向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有______________。
a.增大NH4+的浓度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
c.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二上10月月考化学试卷(解析版) 题型:选择题
一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通入乙烷和氧气,其电极反应式为:C2H6+18OH-—14e -==2CO
-==2CO +12H2O、7H2O+7/2O2+14e-==14OH-,有关此电池的推断正确的是
+12H2O、7H2O+7/2O2+14e-==14OH-,有关此电池的推断正确的是
A.通氧气的电极为负极
B.参加反应的氧气与C2H6的物质的量之比为7∶2
C.放电一段时间后,KOH的物质的量浓度不变
D.电解质溶液中,CO 向正极移动
向正极移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com