
【题目】A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中:C元素的原子最外层电子数是次外层电子数的三倍;A与D、C与F同主族;D是所在周期原子半径最大的主族元素,又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)元素D在周期表中的位置________________。
(2)写出B单质的电子式________________。
(3)C、D、F三种元素形成的简单离子的半径由大到小的顺序是________(用离子符号表示)。
(4)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X,X中所含化学键类型有_________________________。
(5)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:________________________________________________;若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:______________________________________________。
(6)FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的化学方程式_________________________________________________________。
【答案】第三周期第ⅠA族![]() S2->O2->Na+离子键、共价键2Al+ Fe2O3
S2->O2->Na+离子键、共价键2Al+ Fe2O3![]() Al2O3+ 2FeSiO2+2OH-===SiO32-+H2O2SO2+ O2+ 2H2O===2H2SO4
Al2O3+ 2FeSiO2+2OH-===SiO32-+H2O2SO2+ O2+ 2H2O===2H2SO4
【解析】
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中:C元素的原子最外层电子数是次外层电子数的三倍,且是短周期元素,所以C是O元素,C与F同主族,且是短周期元素,所以F是S元素,D与E和F同周期,都处于第三周期,且D是所在周期原子半径最大的主族元素,所以D是Na元素,E的原子序数大于钠小于硫,所以E的单质是固体,六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体,B的原子序数小于C,原子序数小于O,且形成的单质为气体的只有N和H,所以B是N元素,A的单质是气体,则A的原子序数最小,所以A是H元素。
(1)D是Na元素,钠原子核外有3个电子层,最外层有1个电子,所以其在元素周期表中的位置是第三周期第IA族;
(2)氮气分子中氮原子间形成三键,电子式为![]() ;
;
(3)电子层数越多,离子半径越大,电子层结构相同的离子,离子半径随着原子序数的增大而减小,所以C、D、F三种元素形成的简单离子的半径由大到小的顺序是 S2->O2->Na+;
(4)由A、B、C三种元素以原子个数比4:2:3形成化合物X为NH4NO3,硝酸铵中所含化学键类型有离子键和共价键;
(5)若E是金属元素,则为Al元素,铝和氧化铁能发生铝热反应,反应方程式为:2Al+Fe2O3 ![]() Al2O3+2Fe,若E是非金属元素,其单质在电子工业中有重要应用,则E是Si元素,二氧化硅和强碱反应生成硅酸盐和水,离子反应方程式为:SiO2+2OH-=SiO32-+H2O;
Al2O3+2Fe,若E是非金属元素,其单质在电子工业中有重要应用,则E是Si元素,二氧化硅和强碱反应生成硅酸盐和水,离子反应方程式为:SiO2+2OH-=SiO32-+H2O;
(6)SO2气体有毒,且有还原性,二氧化硫和水反应生成亚硫酸,亚硫酸易被氧气氧化生成硫酸,所以该反应的方程式为:2SO2+O2+2H2O=2H2SO4。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在蒸馏实验中,下列说法不正确的是( )
A. 温度计的水银球应放在蒸馏烧瓶的支管口处
B. 冷凝管中冷却水的流向是从上向下流
C. 加入沸石的作用是防止液体暴沸
D. 可以不用温度计
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:C(S,金刚石)+ O2(g)=CO2(g);ΔH=![]() 395.41KJ/mol
395.41KJ/mol
C(S,石墨)+ O2(g)=CO2(g);ΔH=![]() 393.51KJ/mol
393.51KJ/mol
则金刚石转化为石墨的热化学方程式为___________________,由热化学方程式看更稳定的碳的同素异形体是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中含有丰富的卤族元素,可用以下流程分别进行提取。
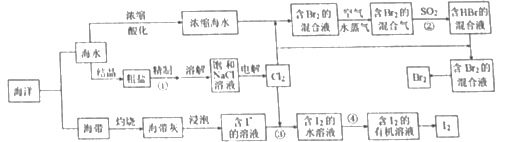
(1)卤族元素在元素周期表中的位置是_________。
(2)①中将粗盐精制的过程中,为除去其中的 Ca2+、 Mg2+、 SO42-,所加以下四种试剂的先后顺序是_________(填序号)。
A 盐酸 B Na2CO3 溶液 C NaOH 溶液 D BaCl2 溶液
(3)②中发生的化学方程式是_________。
(4)③中发生的离子方程式是_________。
(5)④的操作名称是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量锌与浓H2SO4充分在加热下反应生成会SO2和H2的混合气体;锌和稀硫酸反应只有H2生成。现有甲乙两研究小组分别实验探究:
甲研究小组按下图实验验证锌与浓硫酸反应生成物中SO2和H2,取少量的Zn置于b中,向a中加入100mL 18.5mol·L-1的浓硫酸,经过一段时间反应,Zn完全溶解
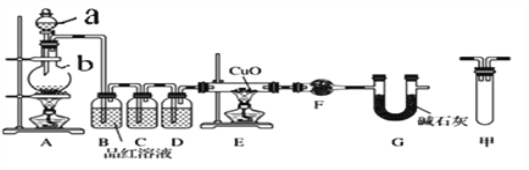
(1)填写仪器名称:a_______________。
(2)写出装置A中生成能使品红溶液褪色的化学反应方程式:_________________。
(3)装置D中加入的试剂是__________。
(4)U型管G的作用为______________。
(5)有同学认为A、B间应增加图中的甲装置,该装置的作用为__________。
(6)证明反应生成SO2和H2的实验现象是_________________。
(7)若A中生成标准状况下的气体33.6L,将A反应后的溶液稀释到1L,测得溶液中H+的浓度为0.1 mol·L-1,则稀释液中SO42-的物质的量浓度是_________ mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据能量变化示意图,下列说法正确的是
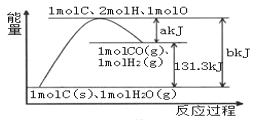
A. 反应物的总能量高于生成物的总能量
B. 2molH和1molO结合生成1molH2O放出热量
C. 1molC和1molH2O反应生成1molCO和1molH2,需要吸收131.3kJ的热量
D. 反应的热化学方程式可表示为:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+(a-b)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作回答问题:
(1)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为: pH(甲)___________pH(乙)(填“大于”、“小于”或“等于”)。
(2)各取25mL的甲、乙两溶液,分别用等浓度的 NaOH 稀溶液中和至 pH=7,则消耗的 NaOH 溶 液的体积大小关系为:V(甲)_____________V(乙)(填“大于”、“小于”或“等于”)。
(3)pH=2的醋酸溶液中由水电离出的c(H+)________0.01mol/LHCl溶液中由水电离出的c(H+)。(填“>”、“<”、或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分是Al2O3、SiO2和Fe2O3等。从铝土矿中提炼Al2O3的流程

下列说法中错误的是
A. 滤液Ⅰ的主要成分是Na2SiO3、NaAlO2和NaOH
B. 滤液Ⅲ的含大量的阴离子是HCO3-
C. 反应Y的离子方程式是2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D. 滤液Ⅱ中通入过量的X的目的是使AlO2-充分沉淀而不引进杂质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com