
【题目】50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
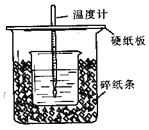
(1)从实验装置上看,图中尚缺少的一种玻璃用品是_______________。
(2)烧杯间填满碎纸条的作用是______________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值____________(填“偏大”、“偏小”、“无影响”)。
(4)实验中60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量__________(填“相等”、“不相等”),所求中和热___________(填“相等”、“不相等”)。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会_________(均填“偏大”、“偏小”、“无影响”);用50mL0.50mol/LNaOH溶液进行上述实验,测得的中和热的数值会__________(均填“偏大”、“偏小”、“无影响”)。
【答案】(1)环形玻璃搅拌棒(2)防止热量散失(3)偏小
(4)不相等;相等 (5)偏小;偏小
【解析】
试题分析:(1)测定中和热,使溶液混合均匀,所以缺少环形玻璃搅拌棒;
(2)为减少实验过程中的热量损失,烧杯间填满碎纸条以减小试验过程中的热量损失;
(3)大烧杯上如不盖硬纸板,反应放出的热量损失,求得的中和热数值偏小;
(4)如果用60mL0.50mol/L盐酸与60mL 0.55mol/L NaOH溶液进行反应,生成的水的物质的量比用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH多,放热不相等;中和热是指生成1mol水放出的热量,与酸碱的用量无关,所求中和热相等;
(5)弱酸、弱碱电离吸热,用相同浓度和体积的氨水(NH3H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会偏小。用50 mL 0.50 mol·L-1NaOH溶液进行上述实验,可能会导致盐酸不能完全反应,因此测得的中和热的数值会偏小。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A. 常温常压下,11.2L NH3所含的原子数为2NA
B. 常温常压下,80g SO3含有的氧原子数为3NA
C. 标准状况下,22.4L H2中所含原子数为NA
D. 一定条件下,56g铁粉与足量的Cl2完全反应转移电子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 明矾既可用作净水剂,也可用作消毒剂
B. 小苏打、氢氧化铝都可用于治疗胃酸过多
C. 煤的干馏和石油的分馏都属于化学变化
D. 已知PM2.5是指大气中直径小于或等于2.5微米(1微米=1000纳米)的颗粒物,则PM2.5在空气中能形成胶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于2molL﹣1 K2SO4溶液的下列说法正确的是( )
A.溶液中含有2mol K2SO4
B.可将2mol K2SO4溶于1L水中制得
C.溶液中c(K+ )=4 molL﹣1
D.1L 溶液中含4molK+ , 4molSO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标况下,H2O的质量为xg,含有y个氢原子,则阿伏加德罗常数为( )
A. 18y/x B. 9y/x C. 18y/ x mol-1 D. 9y/x mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)===2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。

请回答下列问题:
(1)图中A、C分别表示____________、___________;
(2)E表示____________;E的大小对该反应的反应热____________(填“有”或“无”)影响。
(3)该反应通常用V2O5作催化剂,加V2O5会使图ΔH____________(填“变大”、“变小”或“不变”),理由是_____________________。
(4)图中ΔH=________kJ·mol-1;
(5)已知单质硫的燃烧热为296kJ·mol-1,计算由S(s)生成3molSO3(g)的ΔH=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100mL某混合溶液中,c(HNO3)=0.4mol/L,c(H2SO4)=0.1mol/L,向其中加入 1.92g铜粉,微热,充分反应后溶液中c(Cu2+)为
A.0.15mol/L B.0.3mol/L C.0.225mol/L D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性。
I、用如图所示装置进行Mg与SO2反应的实验。

(1)选择制取SO2的合适试剂 。
①10%的H2SO4溶液 ②70%的H2SO4溶液
③Na2SO3固体 ④CaSO3固体
(2)写出装置B中发生的主要反应的化学方程式 。装置C中NaOH溶液的作用是 。
(3)该装置仍有不足之处,请说明在 。
Ⅱ、某研究小组进行了“实验室制Si”的研究,它们以课本为基础,查阅资料得到以下可供参考的四条信息:
①Mg在加热的条件下即可与SiO2反应
②金属硅化物与稀H2SO4反应生成硫酸盐与SiH4
③Si和SiO2均不与稀H2SO4反应
④SiH4在空气中自燃
他们在研究报告中记载着“…选用合适的物质在适宜的条件下充分反应;再用足量稀硫酸溶解固体产物;然后过滤、洗涤、干燥;最后称量…在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的63%左右”.
(4)你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花”的原因是(用化学方程式说明):
① ② ③ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com