
| A. | 44.8 L氟化氢气体分解成22.4 L的氢气和22.4 L的氟气吸收546.6 kJ热量 | |
| B. | 1 mol 氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量大于546.6 kJ | |
| C. | 相同条件下,1 mol 氢气与1 mol氟气的能量总和高于2 mol氟化氢气体的能量 | |
| D. | 2 mol H-F键的键能比 1 mol H-H 键和1 mol F-F键的键能之和大546.6 kJ |
分析 A、热化学方程式的正逆两个过程的焓变符号相反,数值相等;
B、液态氟化氢的能量比气态氟化氢的能量低,根据反应热与能量关系判断;
C、反应物总能量大于生成物的总能量为放热反应,反应物总能量小于生成物的总能量为吸热反应;
D、根据化学反应的焓变和键能之间的关系来回答.
解答 解:A、由热化学方程式可知44.8L即2mol氟化氢气体分解成22.4L即1mol的氢气和22.4L即1mol的氟气吸收546.6 kJ热量,化学计量数表示物质的量,不是体积,故A错误;
B、液态氟化氢的能量比气态氟化氢的能量低,根据能量守恒,1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量大于546.6 kJ,故B正确;
C、反应为放热反应,在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量,故C正确;
D、旧键的断裂吸收能量,新键的生成释放能量,该反应是放热反应,所以2molH-F键的键能比1molH-H键和1molF-F键的键能之和大546.6kJ,故D正确.
故选A.
点评 本题考查学生对热化学方程式的理解、反应热与能量关系,难度不大,注意反应物总能量大于生成物的总能量为放热反应,反应物总能量小于生成物的总能量为吸热反应.


科目:高中化学 来源: 题型:选择题
| A. | 水的摩尔质量是18 g | |
| B. | 0.012 kg 12C中约含有6.02×1023个碳原子 | |
| C. | 1 mol水中约含有6.02×1023个氢原子 | |
| D. | 1 mol任何物质都含有6.02×1023个分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
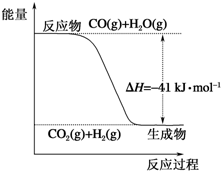 (1)根据图示写出热化学方程式:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ•mol-1.
(1)根据图示写出热化学方程式:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3溶液中加入过量NaOH溶液 HCO3-+OH-=H2O+CO32- | |
| B. | 向次氯酸钠溶液中通入少量的CO2 2ClO-+H2O+CO2=2HClO+CO32- | |
| C. | 向乙二酸(H2C2O4)溶液中滴入少量氢氧化钠溶液 H2C2O4+2OH-=C2O42-+2H2O | |
| D. | 氯化亚铁溶液中加入稀硝酸 3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜时,若转移了NA个电子,则阳极质量减少32 g | |
| B. | 1molSiO2中有2NA个硅氧键 | |
| C. | 1 mol FeCl3跟水反应,完全转化为氢氧化铁胶体后,其中胶体粒子的数目小于NA | |
| D. | 1mol Cl2与过量的铁反应,转移3NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物稳定性最强的是HZ | |
| B. | 室温下,可用Y的容器盛装稀硝酸 | |
| C. | 原子半径由小到大的顺序为:rW<rM<rY | |
| D. | X的单质可通过电解XZ的水溶液获得 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,18 g H2O中含有的质子数为10 NA | |
| B. | 标准状况下,2.24 L C12通入水中,反应转移的电子数为0.1 NA | |
| C. | 常温常压下,53.5 g NH4Cl晶体中含有共价键的数目为4 NA | |
| D. | 常温常压下,2 L 0.5 mol•L-1硫酸钾溶液中阴、阳离子总数大于3 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com