
 乙苯催化脱氢制苯乙烯反应:
乙苯催化脱氢制苯乙烯反应: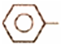 CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ CH=CH2(g)+H2(g)
CH=CH2(g)+H2(g)| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
分析 (1)反应热=反应物总键能-生成物总能键能,由有机物的结构可知,应是-CH2CH3中总键能与-CH=CH2、H2总键能之差;
(2)参加反应的乙苯为nα mol,则: ?
? +H2
+H2
开始(mol):n 0 0
转化(mol):nα nα nα
平衡(mol):n(1-α) nα nα
维持体系总压强p恒定,在温度T时,由PV=nRT可知,混合气体总浓度不变,设反应后的体积为V′,则$\frac{n(1-α)+nα+nα}{{V}^{′}}$=$\frac{n}{V}$,故V′=(1+α)V,再根据平衡常数表达式K=$\frac{c(苯乙烯)×c(氢气)}{c(乙苯)}$计算解答;
(3)①保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向气体体积增大的方向移动;
②600℃时乙苯的转化率与苯乙烯的选择性均较高;结合温度对乙苯转化率、苯乙烯选择性、温度对反应速率与催化剂的影响及消耗能量等,分析控制反应温度为600℃的理由.
解答 解:(1)反应热=反应物总键能-生成物总能键能,由有机物的结构可知,应是-CH2CH3中总键能与-CH=CH2、H2总键能之差,故△H=(5×412+348-3×412-612-436)kJ•mol-1=+124kJ•mol-1,
故答案为:+124;
(2)物质的量为n、体积为V的乙苯蒸气发生催化脱氢反应
参加反应的乙苯为nα mol,则: ?
? +H2
+H2
开始(mol):n 0 0
转化(mol):nα nα nα
平衡(mol):n(1-α) nα nα
维持体系总压强p恒定,在温度T时,由PV=nRT可知,混合气体总浓度不变,设反应后的体积为V′,则$\frac{n(1-α)+nα+nα}{{V}^{′}}$=$\frac{n}{V}$,故V′=(1+α)V,平衡常数K=$\frac{c(苯乙烯)×c(氢气)}{c(乙苯)}$=$\frac{\frac{nα}{(1+α)V}×\frac{nα}{(1+α)V}}{\frac{n(1-α)}{(1+α)V}}$=$\frac{n{α}^{2}}{(1-{α}^{2})V}$,
故答案为:$\frac{n{α}^{2}}{(1-{α}^{2})V}$;
(3)①正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动,提高乙苯的平衡转化率,
故答案为:正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动;
②600℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,转化率较低,温度过高,选择性下降,高温下可能失催化剂失去活性,且消耗能量较大,故选择600℃左右,
故答案为:600℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,转化率较低,温度过高,选择性下降,高温下可能使催化剂失去活性,且消耗能量较大.
点评 本题考查反应热计算、化学平衡常数计算、反应速率及平衡移动的影响因素、对条件控制的分析评价等,(1)中认为苯环存在单双键交替形式不影响计算结果,(2)中平衡常数计算为易错点、难点,注意温度、压强不变,容器的体积发生变化,学生容易认为容器的体积不变,题目难度较大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 双氧水加入稀硫酸和KI溶液:H2O2+2H++2I-═I2+2H2O | |
| C. | Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| D. | Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升温 | B. | c(A)增大 | C. | C(C)降低 | D. | C(A)降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体单质中一定存在σ键,可能存在π键 | |
| B. | σ键可以绕键轴旋转,π键一定不能绕键轴旋转 | |
| C. | π键比σ键的电子云重叠程度大 | |
| D. | CH2=CHCl中C-Cl键采用的成键轨道是sp2-s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往氨水中加水稀释,c(H+)减小 | |
| B. | 500℃左右的温度比室温更有利于氨的生成 | |
| C. | 加入催化剂有利于SO3的合成 | |
| D. | 实验室中常用排饱和食盐水的方法收集Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作 |
| A | 验证NaCl溶液中混有盐酸 | 取少量溶液,滴加无色酚酞溶液 |
| B | 比较Fe、Cu、Ag的金属活动性 | 铁丝浸入CuSO4溶液,铜丝浸入AgNO3溶液 |
| C | 除去铁制品上的铁锈 | 将铁制品长时间浸泡在足量的稀硫酸中 |
| D | 除去粗盐中的难溶性杂质 | 将粗盐研碎、溶解、蒸发 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | CaO | SiO2 | Al2O3 | Fe2O3 | MgO | CaS | 其他不溶于酸的物质 |
| 质量分数(%) | 65~66 | 3.5~5.0 | 1.5~3.5 | 0.2~0.8 | 0.2~1.1 | 1.0~1.8 | 23-26 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com