
【题目】下列电离方程式书写正确的是( )
A.H2S 的电离方程式:H2S+H2O![]() H3O++HS-
H3O++HS-
B.NaHCO3在水溶液中的电离方程式:NaHCO3===Na++H++CO32-
C.NaHSO4在水溶液中的电离方程式:NaHSO4===Na++HSO42-
D.NaHSO4在熔融状态的电离方程式:NaHSO4===Na++H++SO42-
【答案】A
【解析】
强电解质完全电离,溶质微粒在溶液中以离子形式存在,书写电离方程式用等号;弱电解质只有少部分电离,溶质微粒在溶液中多数以分子形式存在,少数以离子形式存在,书写电离方程式用可逆号,多元弱酸分步电离,多元弱碱一步写到位。
A、H2S为多元弱酸应该分步电离,以第一步电离为主,电离方程式为:H2S+H2OH3O++HS-,故A正确;
B、碳酸氢钠为强电解质,完全电离,方程式:NaHCO3=Na++HCO3-,故B错误;
C、硫酸氢钠为强电解质,水溶液中完全电离生成钠离子、氢离子、硫酸根离子,电离方程式:NaHSO4═Na++H++SO42-,故C错误;
D、硫酸氢钠熔融完全电离生成钠离子、硫酸氢根离子,NaHSO4=Na++HSO4-,故D错误。
答案选A。


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 氢氧燃料电池正极消耗22.4 L气体时,负极消耗的气体分子数目为2NA
B. 2.0gD2O中含有的质子数、电子数均为NA
C. 向含有FeI2的溶液中通入适量氯气,当有1molFe2+被氧化时,该反应转移电子数目一定为3NA
D. 14g分子式为CnH2n的烃中含有的共价键的数目一定为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂利用褐煤烟灰(主要成分为碳、二氧化锗,还有少量氧化铝和二氧化硅)制取纯GeO2的主要流程如下:

已知:GeO2是一种难溶于水的偏弱酸性的两性氧化物,GeCl4的沸点是83.1℃。
(1)写出二氧化锗与碳酸钠焙烧时发生反应的化学方程式:_______________。
(2)用水浸取焙烧物长达2小时的目的是_______________________。
(3)“酸化”至溶液中盐酸浓度为5.3 mol·L-1时有利于生成四氯化锗,写出该反应的化学方程式:_____________。
(4)若滤液“酸化”时酸度不够,溶液会出现明显的浑浊,原因是_____________________。
(5)操作“X”的名称为________________。
(6)四氯化锗与高纯水反应的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
A. 该溶液的pH=4 B. 升高温度,溶液的pH增大 C. 此酸的电离平衡常数约为1×10-7 D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某复合肥的主要成分有KCl、NH4H2PO4和CO(NH2)2等。测定该复合肥中氮的质量分数的实验步骤如下:
步骤1:准确称取0.5000 g样品于锥形瓶中,加入足量浓硫酸并加热,不再有CO2溢出时,冷却至室温。
步骤2:向锥形瓶中加入100mL蒸馏水,再加入适量的CaCl2溶液,并用NaOH溶液调节溶液近中性,过滤,洗涤,得0.1550 gCa3(PO4)2沉淀和滤液A。
步骤3:向滤液A中加入过量的甲醛溶液,加指示剂,用0. 5000 mol/LNaOH标准溶液滴定至终点,消耗NaOH溶液22.00 mL。 [已知:4 NH4++6HCHO=4H++(CH2)6N4+6H2O]
(1)步骤1中,CO(NH2)2与硫酸反应的化学方程式为____________________。
(2)欲使滤液A中c(PO43—)≤4.0×10-6mol/L,应保持溶液中c(Ca2+)≥______________mol/L[已知KSP[Ca3(PO4)2]=2.0×10-33]。
(3)复合肥样品中N的质量分数为___________。
(4)计算复合肥样品中NH4H2PO4和CO(NH2)2的物质的量之比_____________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于盐类水解的说法错误的是( )
A.等温下,物质的量浓度相等的①NaHCO3、②Na2CO3、③NaOH溶液的pH大小:③ > ② > ①
B.浓度均为0.1mol/L的 ①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为:① > ② > ③
C.在NH4Cl溶液中加入稀HNO3,能抑制NH4+水解
D.在CH3COONa溶液中加入冰醋酸,能抑制CH3COO-水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应A2+3B2![]() 2AB3 以下表示的反应速率中,速率最大的是( )
2AB3 以下表示的反应速率中,速率最大的是( )
A. V(A2)=0.4 molL-1min-1 B. V(B2)=0.8 molL-1min-1
C. V(AB3)=0.6 molL-1min-1 D. V(A2)=0.01 molL-1S-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发展储氢技术是氢氧燃料电池推广应用的关键.研究表明液氨是一种良好的储氢物质,其储氢容量可达![]()
![]() 质量分数
质量分数![]() 液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池.氨气分解反应的热化学方程式如下:
液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池.氨气分解反应的热化学方程式如下:![]()
请回答下列问题:
![]() 氨气自发分解的反应条件是 ______ .
氨气自发分解的反应条件是 ______ .
![]() 已知:
已知:![]()
![]()
![]()
![]()
则,反应![]()
![]() 的
的![]() ______ .
______ .
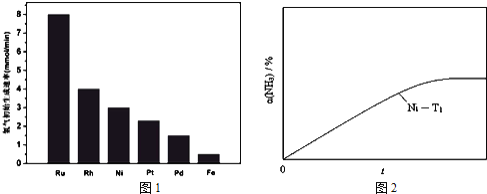
![]() 研究表明金属催化剂可加速氨气的分解.图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率.
研究表明金属催化剂可加速氨气的分解.图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率.
①不同催化剂存在下,氨气分解反应的活化能最大的是 ______ ![]() 填写催化剂的化学式
填写催化剂的化学式![]() .
.
②恒温![]() 恒容时,用Ni催化分解初始浓度为
恒容时,用Ni催化分解初始浓度为![]() 的氨气,并实时监测分解过程中氨气的浓度.计算后得氨气的转化率
的氨气,并实时监测分解过程中氨气的浓度.计算后得氨气的转化率![]() 随时间t变化的关系曲线
随时间t变化的关系曲线![]() 如图
如图![]() 请在图2中画出:在温度为
请在图2中画出:在温度为![]() ,Ru催化分解初始浓度为
,Ru催化分解初始浓度为![]() 的氨气过程中
的氨气过程中![]() 随t变化的总趋势曲线
随t变化的总趋势曲线![]() 标注
标注![]() ______
______
③如果将反应温度提高到![]() ,请如图2中再添加一条Ru催化分解初始浓度为
,请如图2中再添加一条Ru催化分解初始浓度为![]() 的氨气过程中
的氨气过程中![]() 的总趋势曲线
的总趋势曲线![]() 标注
标注![]() ______
______
④假设Ru催化下温度为![]() 时氨气分解的平衡转化率为
时氨气分解的平衡转化率为![]() ,则该温度下此分解反应的平衡常数K与
,则该温度下此分解反应的平衡常数K与![]() 的关系式是:
的关系式是:![]() ______ .
______ .
![]() 用Pt电极对液氨进行电解也可产生
用Pt电极对液氨进行电解也可产生![]() 和
和![]() 阴极的电极反应式是 ______ ;阳极的电极反应式是 ______
阴极的电极反应式是 ______ ;阳极的电极反应式是 ______ ![]() 已知:液氨中
已知:液氨中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在20℃时,两种气态烃和氧气的混合物装入密闭容器中点燃爆炸,又恢复到20℃,此时容器中气体压强为反应前的一半,用氢氧化钠溶液吸收后容器内几乎真空,此两种烃可能是( )
A.CH4 C6H12B.CH4 C3H4C.C2H6 C3H8D.C6H6 C2H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com