
【题目】氮及其化合物在工农业生产、生活中有着重要作用.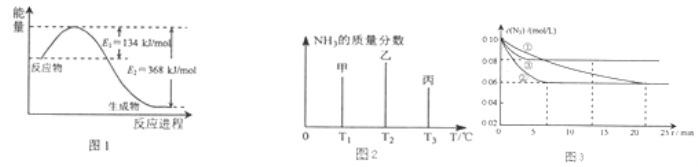
(1)图1是1molNO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 .
(2)在固定容积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1 用一定物质的量的N2和H2合成NH3 , 三个容器的反应温度分别为T1、T2、T3且恒定不变,在其它条件相同的情况下,实验测得反应均进行到t min时NH3的质量分数如图2所示:
此时甲、乙、丙三个容器中一定达到化学平衡状态的是容器,都达到平衡状态时,NH3的质量分数最高的是容器(填甲、乙、丙).
图3是实验室在三个不同条件的密闭容器中,分别加入浓度均为c(N2)=0.10mol/L,c(H2)=0.26mol/L进行反应时,N2的浓度随时间的变化如图①、②、③曲线所示.
Ⅰ该反应实验②平衡时H2的转化率为 .
Ⅱ据图3所示,②装置中有一个条件与①不同,请指出②相对①改变的条件 .
Ⅲ计算实验③的平衡常数为 .
(3)铜与一定浓度硝酸反应时方程式可表示为:Cu+HNO3一Cu(NO3)2+NO+NO2+H2O(方程式未配平).3.2g Cu被硝酸完全溶解后,如果得到的NO和NO2物质的量相同,则得到标准状况下NO体积为 L.
【答案】
(1)CO(g)+NO2(g)=CO2(g)+NO(g)△H=﹣234KJ/mol
(2)丙;甲;46.15%;加入催化剂;2.5L2?mol﹣2
(3)0.56
【解析】解:(1)该反应的焓变△H=E1﹣E2=134KJ/mol﹣368KJ/mol=﹣234KJ/mol,所以热化学方程式为CO(g)+NO2(g)=CO2(g)+NO(g)△H=﹣234 KJ/mol,
所以答案是:CO(g)+NO2(g)=CO2(g)+NO(g)△H=﹣234 KJ/mol.
(2.)该反应是从正反应方向开始的,所以随着反应的进行,氨气的浓度逐渐增大,其含量也在不断升高,当反应达到平衡时达到最大值.此后,随着反应温度的升高,化学平衡逆向移动,氨气的浓度逐渐降低,其含量也在不断减少.由于T3比T2时少,说明T3的状态丙是已经达到平衡状态的.若三者都达到平衡状态.由于温度T1<T2<T3 . 升高温度,化学平衡向逆反应方向移动,氨气的质量分数降低.温度越高,逆向进行的程度越大,氨气质量分数越低,所以在都达到平衡状态时,氨气的质量分数最高的是甲.
Ⅰ、因为浓度变化量之比等于化学计量数之比,所以△c(H2)=3△c(N2)=3×(0.1﹣0.06 )mol/L=0.12mol/L,实验②平衡时H2的转化率为α(H2)= ![]() =
= ![]() =46.15%.
=46.15%.
Ⅱ、根据图示的信息可知:②到达平衡的时间比①短,到达平衡时N2的浓度与①相同,化学平衡不移动,故②与①相比加了催化剂.
Ⅲ、根据三段式计算得到平衡时各物质的浓度
N2(g) | + | 3H2(g) | = | 2NH3(g) | |
起始浓度: | 0.1 | 0.26 | 0 | ||
转化浓度: | 0.1﹣0.08=0.02 | 0.02×3=0.06 | 0.02×2=0.04 | ||
平衡浓度: | 0.08 | 0.26﹣0.06=0.2 | 0.04 |
平衡常数K= ![]() L2mol﹣2=2.5L2mol﹣2
L2mol﹣2=2.5L2mol﹣2
所以答案是:丙; 甲;46.15%;加入催化剂;2.5L2mol﹣2;
(3.)参与反应的n(铜)= ![]() =0.5mol,设生成的NO的物质的量为x,则NO2的物质的量也为x,氧化还原反应中得失电子总数相等,铜失去的电子总数=氮得到的电子总数,则有0.05mol×2=3x+x,x=0.025mol,NO的体积为0.025mol×22.4L/mol=0.56L,
=0.5mol,设生成的NO的物质的量为x,则NO2的物质的量也为x,氧化还原反应中得失电子总数相等,铜失去的电子总数=氮得到的电子总数,则有0.05mol×2=3x+x,x=0.025mol,NO的体积为0.025mol×22.4L/mol=0.56L,
所以答案是:0.56.
【考点精析】通过灵活运用反应热和焓变和化学平衡状态本质及特征,掌握在化学反应中放出或吸收的热量,通常叫反应热;化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)即可以解答此题.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】利用右图装置探究铁在海水中的电化学防护,下列说法不正确的是( ) 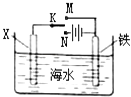
A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀
B.若X为锌棒,开关K置于M处,铁电极的反应:Fe﹣2e﹣→Fe2+
C.若X为碳棒,开关K置于N处,可减缓铁的腐蚀
D.若X为碳棒,开关K置于N处,铁电极的反应:2H++2e﹣→H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将m1g铜铝合金投入到1 L含H2SO4和HNO3的混合溶液中,合金完全溶解后只生成VL —氧化氮气体(标准状况),向反应后的溶液中逐滴加入1mol/L NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如下图所示。下列说法中不正确的是:
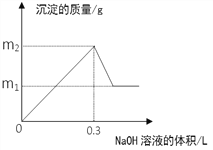
A. 2c(H2SO4) + c(HNO3) = 0.8 mol·L-1
B. m2—m1=5.1
C. 原合金中铝的质量分数为34.7%
D. V = 2.24
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,水溶液中c(H+)与c(OH﹣)有如图所示关系,下列有关说法正确的是( ) 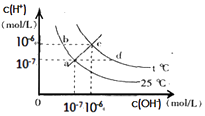
A.c点对应的溶液中大量存在的离子可能为:Na+、H+、Cl﹣、NO3﹣
B.将25℃时的KCl溶液加热到t℃,则该溶液中的c(OH﹣)由a点变化到b点
C.t℃<25℃
D.ac线上的任意一点溶液均有c(H+)=c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素A、B的质子数分别是a和b,它们的离子Am+和Bn-的核外电子排布相同,则下列关系式中正确的是( )
A. a=b+m-nB. a=b-m+nC. a=b+m+nD. a=b-m-n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲同学利用下图所示装置进行硝酸、氮氧化物的相关实验:
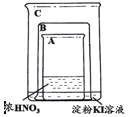
实验1:将铜片放入烧杯A后,立即用烧杯B盖住
(1)烧杯A液体上方出现大量红棕色气体,该反应的化学方程式为_________________
(2)一段时间后,红棕色气体消失,烧杯C中的液体变成蓝色,甲同学分析出现蓝色的原因,认为其中涉及到两个反应:
①红棕色气体消失,该化学方程式为_____________________________________________
②配平溶液出现蓝色的离子方程式,并用单线桥法标出电子转移方向和数目:
________I-+________![]() +________H+=________I2+________NO↑+________H2O
+________H+=________I2+________NO↑+________H2O
(3)打开烧杯B,A液体上方又出现淡棕色,该反应的化学方程式为__________________
实验Ⅱ:因为有其他同学对淀粉KI溶液变蓝的原因提出异议,甲同学将铜片换成铁片放入烧杯A后,立即用烧杯B盖住。
(4)实验前甲同学认为换为铁片后不应出现红棕色气体,淀粉KI溶液不会变为蓝色,其理由是____________________________________________________________________
(5)实验开始后,发现确实无红棕色气体生成,但过一段时间后,淀粉KI溶液仍然变为蓝色,请你帮忙分析其中的原因_________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列有关说法正确的是( )
A. 100mL12mol/L浓盐酸与足量的MnO2加热充分反应生成Cl2分子数为0. 3 NA
B. 80gSO3在标准状况下所占体积约为22.4L
C. 向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,转移的电子的数目为NA
D. 5.4g铝粉与足量的氢氧化钠溶液充分反应生成H2分子数为0. 3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,如图是扇形元素周期表的一部分,对比中学常见元素周期表,思考扇形元素周期表的填充规律,下列说法正确的是( )

A. ②、⑧、⑨对应简单离子半径依次减小
B. 该表中标注的元素全部是主族元素
C. 元素⑥和⑦的原子序数相差11
D. ④的最高价氧化物对应的水化物能与其氢化物反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com