
【题目】X、Y、Z均为短周期元素,原子序数依次增大,X和Y同主族,Y和Z同周期,Y与Z能形成离子个数比为1︰1的离子化合物A,X与Z能形成原子个数比为1︰1的共价化合物B,它们之间转化关系如图(部分产物已略去):
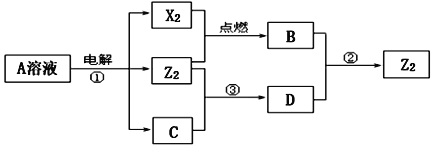
(1)Y在周期表的位置是_____,C的电子式是_____。
(2)反应①的化学方程式为_____。
(3)D溶液呈碱性的原因是(用离子方程式表示)_____。
(4)反应②的离子方程式为_____。
(5)工业上常将C溶液置于铁锅内直接加热得到固体C,此过程中会生成氢氧化亚铁等杂质,可加入硝酸钠使氢氧化亚铁氧化,然后脱水变成氧化铁沉降得到较纯的固体C。写出加入硝酸钠除杂的化学方程式_____。
【答案】第三周期第IA族 ![]() 2 NaCl+2H2O
2 NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑ ClO—+ H2O
2NaOH+Cl2↑+H2↑ ClO—+ H2O ![]() HClO +OH— ClO—+Cl—+2H+ =Cl2↑+ H2O 10Fe(OH)2+2NaNO3+6H2O=10Fe(OH)3+2NaOH+N2↑、2Fe(OH)3=Fe2O3↓+3H2O
HClO +OH— ClO—+Cl—+2H+ =Cl2↑+ H2O 10Fe(OH)2+2NaNO3+6H2O=10Fe(OH)3+2NaOH+N2↑、2Fe(OH)3=Fe2O3↓+3H2O
【解析】
短周期元素X、Y、Z的原子序数依次增大,Y与Z能形成离子个数比为1:1的离子化合物A,电解A溶液可得X2、Z2单质及C,有三种物质生成,其中两种单质为双原子分子,应为电解水与电解质型的电解,则A为盐溶液,该盐溶液盐的阳离子不能放电,酸根离子放电,则A为NaCl,Y为Na,Z为Cl,故X2为H2、Z2为Cl2、C为NaOH.X和Y同主族,X与Z能形成原子个数比为1:1的共价化合物为HCl,H2与Cl2反应生成B为HCl,氯气能与氢氧化钠反应生成D为NaClO,NaClO能与HCl反应生成氯气。
(1)Y为钠元素,原子核外有3个电子层,最外层有1个电子,处于周期表第三周期第IA族;C为NaOH,电子式为![]() ;
;
(2)反应①为电解氯化钠溶液,生成氢气、氯气与氢氧化钠,反应方程式是:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑;
2NaOH+Cl2↑+H2↑;
(3)D为NaClO,为强碱弱酸盐,溶液中ClO-水解:ClO-+H2OHClO+OH-,溶液呈碱性;
(4)反应②是盐酸与次氯酸钠反应,生成氯化钠、氯气与水,反应的离子方程式为ClO-+Cl-+2H+=Cl2↑+H2O;
(5)工业上常将NaOH溶液置于铁锅内直接加热得到固体NaOH,此过程中会生成氢氧化亚铁等杂质,可加入硝酸钠使氢氧化亚铁氧化,然后脱水变成氧化铁沉降得到较纯的固体NaOH.加入硝酸钠除杂的化学方程式:10Fe(OH)2+2NaNO3+6H2O=10Fe(OH)3+2NaOH+N2↑、2Fe(OH)3=Fe2O3+3H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】我国科学家提出用CO2置换可燃冰(mCH4·nH2O) 中CH4的设想,置换过程如图所示,下列说法正确的是
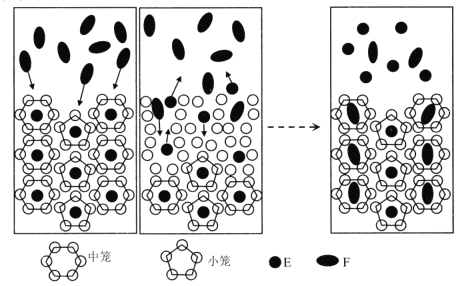
A.E代表CO2, F代表CH4
B.笼状结构中水分子间主要靠氢键结合
C.CO2置换出CH4的过程是化学变化
D.CO2可置换可燃冰中所有的CH4分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
2 H2(g)+ O2(g)= 2H2O(g)△H2
C(s)+ O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为
A. 12△H3+5△H2-2△H1 B. 2△H1-5△H2-12△H3
C. 12△H3-5△H2-2△H1 D. △H1-5△H2-12△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法不正确的是
A.常温下将5.6 g 铁加到足量浓硫酸中,转移电子数为0.3 NA
B.常温常压下,28 g丙烯中所含C-H键的数目为4 NA
C.1 L 3.0 mol·L-1的 NH4Cl溶液中,NH4+ 数目小于3 NA
D.2.0 g重水 (D2O) 中含有的中子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件未标出),其中反应①是置换反应,B、C、F都是气态单质,且B为黄绿色;反应③中有水生成,反应②需要放电才能发生,A和D相遇有白烟生成。
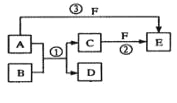
(1)反应③的化学方程式为:_________________;
(2)反应①中每生成1 molC,转移的电子数为______________;
(3)A与D的水溶液恰好完全反应时,其生成物的水溶液呈_____性(填“酸”“碱”或“中”),该水溶液中存在着如下关系,用粒子浓度符号填写。
①c(H+)+____= c(OH-)+ c(Cl-);
②c(H+)= c(OH-)+____;
(4)元素X与组成B的元素同周期,X的单质既可与酸反应也可与碱反应且都生成H2,则
①X的单质与碱反应的离子方程式_____________________________;
②X、空气、海水可以组成新型海水标志灯的电池。该电池以海水为电解质溶液,靠氧气使X不断氧化而源源不断产生电流,只要把灯放入海水中,数分钟后就会发出耀眼的闪光,其能量比干电池高20~50倍。则该新型电池的正极的电极反应式为________________;原电池的总反应方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】有机玻璃是一种高分子化合物,在工业上和生活中有着广泛用途,工业上合成有机玻璃流程为:

下列说法不正确的是
A. 反应①的原子利用率达100%
B. 反应②是加聚反应
C. 相对分子质量为86,且与甲基丙烯酸甲酯具有相同官能团的有机物有5种
D. 甲基丙烯酸甲酯能使酸性高锰酸钾褪色,也能使Br2/CCl4褪色,二者原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质之间有如下反应关系:
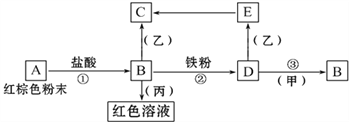
已知由E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色。
回答:
(1) 写出下列物质的化学式:A______B______D________甲_______乙_______丙__________
(2) 写出E→C反应的化学方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组设计以下装置进行实验:
(1)按如图所示装置进行实验,填写有关现象及化学方程式。

①B中浓硫酸的作用是__________________________________。
②C中发生反应的化学方程式为______________________________________________________。
③D中的现象是___________________________________________。
(2)用如图所示装置制取纯净的O2。

①若C是一种淡黄色固体,则烧瓶中发生反应的化学方程式是______________________。
②若C是一种黑色粉末,则B物质是________,C物质的作用是__________________。
③洗气瓶(广口瓶)中装的试剂D是________,其作用是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为3∶1)直接作燃料,其工作原理如图所示,并以此电源用于工业生产。
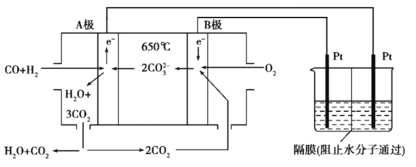
(1)H2(g)、CO(g)的燃烧热ΔH分别为-285.8kJ·mol-1、-283.0kJ·mol-1,1g液态水变为水蒸气时吸热2.44kJ,则电池总反应3CO(g)+H2(g)+2O2(g)=3CO2(g)+H2O(g)的ΔH=___________kJ·mol-1,B电极上发生反应的电极反应式为___________。
(2)若以此电源生产新型硝化剂N2O5,装置如上图所示。已知两室加入的试剂分别是a.硝酸溶液b.N2O4+无水硝酸,则左室加入的试剂应为___________(填“a”或“b”),其电极反应式为___________。
(3)若以此电源用惰性电极电解足量的硝酸银溶液,阴极产物的质量为5.4g,则阳极产生的气体在标准状况下的体积为___________L。电解后溶液体积为500mL,溶液的pH约为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com