
| A. | 单质的颜色随核电荷数的增加而加深 | |
| B. | 单质的熔、沸点随核电荷数的增加而升高 | |
| C. | 它们的氢化物的还原性随核电荷数的增加而增强 | |
| D. | 它们的氢化物的稳定性随核电荷数的增加而增强 |
分析 F、Cl、Br、I位于周期表同一主族,原子序数逐渐增大,原子核外电子层数逐渐增加,半径逐渐增大,熔沸点随核电荷数的增加而增加;元素的非金属性逐渐减弱,则对应氢化物的稳定性质逐渐减弱,但颜色逐渐加深.
解答 解:A、卤族元素单质从F到I,其颜色分别为:淡黄绿色、黄绿色、深红棕色、紫红色,所以卤族元素单质的颜色随着核电荷数增大而加深,故A正确;
B、F、Cl、Br、I位于周期表同一主族,它们的熔沸点随核电荷数的增加而增加,故B正确;
C、元素的非金属性越强,离子的还原性越弱,从F到I,其非金属性随着核电荷数增大而减弱,所以它们的气态氢化物的还原性随核电荷数的增加而增强,故C正确;
D、元素的非金属性越强,其气态氢化物的稳定性越强,从F到I,其非金属性随着核电荷数增大而减弱,所以其气态氢化物的稳定性逐渐减弱,故D错误;
故选D.
点评 本题考查了卤族元素结构和性质的关系,结构决定性质,根据结构分析其性质,熟练掌握元素周期律知识,题目难度不大.


科目:高中化学 来源: 题型:解答题
 有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数.R是由A、D两元素形成的离子化合物,其中A与D离子数之比为2:1.请回答下列问题:
有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数.R是由A、D两元素形成的离子化合物,其中A与D离子数之比为2:1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
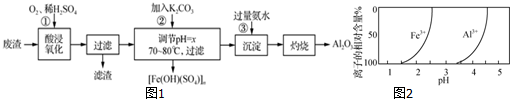
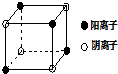
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.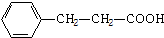 .
. 单体.
单体.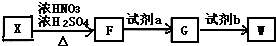
 ,试剂a为酸性KMnO4 溶液.
,试剂a为酸性KMnO4 溶液.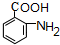 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +(n-1)H2O.
+(n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | -- |
| 最低负价 | -- | -1 | -- | --- | -3 | -2 | |
| A. | 元素X和Q形成的化合物中不可能含有共价键 | |
| B. | X、Z、M的单质分别与水反应,Z最剧烈 | |
| C. | X、Z、R的最高价氧化物对应的水化物之间可两两相互反应 | |
| D. | Y的氧化物对应的水化物的酸性一定强于R的氧化物对应水化物的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ③⑤ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在由水电离产生的氢离子浓度为10-13 mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3-四种离子能大量共存 | |
| B. | 已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)?c(CO32-)=6.82×10-6 | |
| C. | 对于反应2N2H4(l)=N2(g)+2H2(g),△H=-50.6 kJ?mol-1,它只在高温下自发进行 | |
| D. | 常温下,将0.2 mol?L-1某一元碱(ROH)溶液和0.1 mol?L-1HCl溶液等体积混合,混合后溶液pH<7,则c(ROH)>c(R+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com