
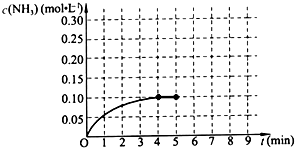
 已知工业上合成氨的反应:N2(g)+3H2(g)?2NH3(g)△H<0.在一体积为2L的密闭容积中,加入0.20mol的N2和0.60mol的H2,反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
已知工业上合成氨的反应:N2(g)+3H2(g)?2NH3(g)△H<0.在一体积为2L的密闭容积中,加入0.20mol的N2和0.60mol的H2,反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:分析 (1)依据平衡常数概念写出,用生成物浓度的幂次方乘积除以反应物浓度的幂次方乘积;
(2)分析图象到4min氨气的浓度增大0.10mol/L,依据化学反应速率概念计算得到;
(3)体积缩小一半相当于增大体系的压强,平衡向气体分子数减小的方向即正反应方向移动;
(4)在第5分钟时将容器的体积瞬间缩小一半后,若在第8分钟时达到新的平衡(此时NH3的浓度约为0.25mol•L-1),图象起点标对,拐点、平台、走势是绘制关键;先判断把容器的体积缩小一半的瞬间氨气的浓度,再结合平衡时的浓度作图.
解答 解:(1)N2(g)+3H2(g)?2NH3(g),反应平衡常数的表达式 K=$\frac{c{\;}^{2}(NH{\;}_{3})}{c(N{\;}_{2})c{\;}^{3}(H{\;}_{2})}$;
故答案为:$\frac{c{\;}^{2}(NH{\;}_{3})}{c(N{\;}_{2})c{\;}^{3}(H{\;}_{2})}$;
(2)反应进行到4分钟到达平衡.请计算从反应开始到刚刚平衡,平均反应速率v(NH3)=$\frac{0.10mol/L}{4min}$=0.025mol/(L•min);
故答案为:0.025mol/(L•min);
(3)该反应是气体体积减小的反应,把容器的体积缩小一半,增大了反应体系的压强,增大压强,平衡向气体体积减小的方向移动,即向正反应方向移动;化学平衡常数只与温度有关,温度不变,平衡常数不变.
故答案为:向正反应方向;若只把容器的体积缩小一半,各种物质的浓度都加倍,浓度熵Q<K,平衡向正向移动;不变;
(4)把容器的体积缩小一半的瞬间氨气的浓度,氨气的浓度变为0.20mol/L,平衡后浓度约为0.25mol/L,图象为: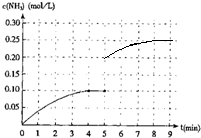 ,
,
故答案为: ,
,
点评 本题考查了化学反应速率的定量表示方法、化学平衡常数、化学平衡的影响因素,原电池电极反应等知识点,同一化学反应中化学平衡常数只与温度有关,与反应物、生成物的浓度无关,图象分析绘制是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA | |
| B. | 常温常压下,22 g CO2中所含的共用电子对数为2NA | |
| C. | 25℃时,pH=2的醋酸冲稀10倍后,溶液中H+数目大于0.001 NA | |
| D. | 密闭容器中加入一定量的H2和N2,反应生成1mol NH3时转移电子数小于3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-) | B. | pH>7,且c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | ||
| C. | pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | D. | pH=7,且c(CH3COO-)>c(Na+)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 实验室用乙酸和正丁醇制备乙酸正丁醇,有关物质的相关数据如下表:
实验室用乙酸和正丁醇制备乙酸正丁醇,有关物质的相关数据如下表:| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度/(g/100g水) |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①②③⑤ | C. | ①②③④ | D. | ①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com