
A.①>②>③>④ B.④>③>②>①
C.④>②>①>③ D.②>③>①>④
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
(1)选择题
①根据下列热化学方程式
(1)C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ/mol
(2)H2(g)+![]() O2(g)===H2O(l) ΔH2=-285.8 kJ/mol[Ks5u.com]
O2(g)===H2O(l) ΔH2=-285.8 kJ/mol[Ks5u.com]
(3)CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH3=-870.3 kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为( )
A.ΔH=-488.3 kJ/mol B.ΔH=+244.1 kJ/mol
C.ΔH=-996.6 kJ/mol D.ΔH=+996.6 kJ/mol
 ②右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )
②右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )
A.a为负极、b为正极
B.a为阳极、b为阴极
C.电解过程中、d电极质量增加
D.电解过程中,氯离子浓度不变
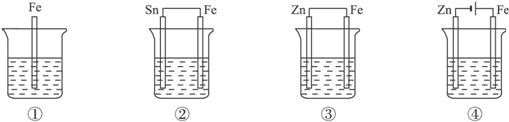
③如下图所示,各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为( )
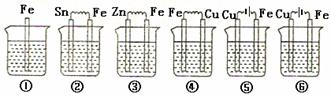
A.②①③④⑤⑥ B.⑤④③①②⑥
C.⑤④②①③⑥ D.⑤③②④①⑥
(2)通常人们把拆开1mol化学键所吸收的能量看成键能,键能的大小可以衡量化学键的强弱,也可以用于计算化学反应中的反应热(△H),化学反应中的△H等于反应中断裂的化学键的键能之和与反应中形成新的化学键的键能之和的差
| 化学键 | Si—Cl | H—H | H—Cl | Si—Si |
| 键能/KJ.mol | 360 | 436 | 431 | 176 |
工业上高纯硅可通过下列反应制取:
SiCl4(g)+2H2(g)==Si(s)+4HCl(g),该反应的反应热△H为多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com