
| A. | 高温下Mg2+得电子的能力比Rb+弱 | |
| B. | MgCl2对热的稳定性比RbCl强 | |
| C. | 在一定条件下,Mg的金属性比Rb强 | |
| D. | 铷的沸点比镁低,及时抽走铷蒸气使平衡向正反应方向移动 |
分析 根据元素周期表中元素性质的递变规律以及物质的性质来回答,反应方程式2RbCl2+Mg$\stackrel{熔融}{?}$MgCl2+2Rb↑可知生成物Rb为气态,把铷蒸气抽出,则减少了生成物的浓度,根据平衡移动原理分析,
A.Mg的还原性小于Rb,则镁离子的得电子能力比Rb+强;
B.MgCl2的热稳定性比RbCl强;
C.Mg的金属性小于Rb;
D.根据反应方程式可知生成物Rb为气态,把铷蒸气抽出,则减少了生成物的浓度,根据平衡移动原理分析.
解答 解:A.活泼性越强,对应离子的氧化性越弱,则得电子能力越弱,由于Rb的活泼性大于Mg,则Mg2+得电子的能力比Rb+强,故A错误;
B.MgCl2的离子键比RbCl强,MgCl2的热稳定性比RbCl强,且两者稳定性与真空炼铷的原理无关,故B错误;
C.铷的金属活动性大于Na,Na的活泼性大于金属Mg,故Rb的活泼性大于Mg,故C错误;
D.已知真空炼铷的原理如下:2RbCl+Mg═MgCl2+2Rb(气),该条件下,生成物Rb为气态,把铷蒸气抽出,则减少了生成物的浓度,平衡向正方向移动,所以反应可以不断向生成Rb(气)方向进行,故D正确;
故选D.
点评 本题考查了金属活动性顺序表及其应用,题目难度中等,根据平衡移动原理来分析减少了生成物的浓度平衡正向移动是解答关键,试题培养了学生的灵活应用能力.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:解答题

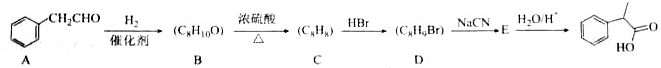
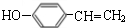 .
.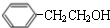 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$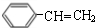 +H2O;C→D的反应类型为加成反应
+H2O;C→D的反应类型为加成反应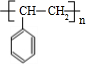 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某位同学在查阅资料时发现含氮化合物有以下性质:
某位同学在查阅资料时发现含氮化合物有以下性质:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图①用于除Cl2中混有的HCl气体 | |
| B. | 图②可用于制取并收集少量NO2气体 | |
| C. | 图③所示实验装置可用排空气法收集CO2 | |
| D. | 图④所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.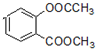 +3NaOH→CH3COONa+CH3OH+
+3NaOH→CH3COONa+CH3OH+ +H2O.
+H2O.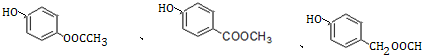 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | M与A均能使酸性高锰酸钾溶液和溴水褪色 | |
| B. | B能发生消去、氧化、取代、缩聚等反应 | |
| C. | 1 mol M与足量烧碱溶液反应,可消耗2n mol NaOH | |
| D. | A、B、C各1 mol分别与金属钠反应,放出气体的物质的量之比为1:2:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应为化合反应 | |
| B. | “通路”是胶体对光产生的丁达尔现象 | |
| C. | 上述反应为氧化还原反应 | |
| D. | 产生的臭氧有毒,会严重影响人体健康 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 对于2NO2(g)═N2O4(g)△H<0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.则下列说法正确的是( )
对于2NO2(g)═N2O4(g)△H<0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.则下列说法正确的是( )| A. | A、C两点的反应速率:A>C | |
| B. | A、C两点气体的颜色:A深、C浅 | |
| C. | B、C两点的气体的平均分子质量:B<C | |
| D. | 由状态B到状态A,可以用加热方法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com