
分析 整个过程中涉及废液中加入过量的铁粉,铁与氯化铁溶液和铁与氯化铜反应,铁与氢离子反应,反应的离子方程式为:2Fe3++Fe=3Fe2+,Fe+Cu2+=Cu+Fe2+,Fe+2H+=Fe2++H2↑;根据强制弱判断四种阳离子的氧化性,由此分析解答.
解答 解:涉及废液中加入过量的铁粉,铁与氯化铁溶液和铁与氯化铜反应,铁与氢离子反应,反应的离子方程式为:2Fe3++Fe=3Fe2+,Fe+Cu2+=Cu+Fe2+,Fe+2H+=Fe2++H2↑;根据强制弱得到:Fe3+>Cu2+>H+>Fe2+,故答案为:2Fe3++Fe=3Fe2+,Fe+Cu2+=Cu+Fe2+,Fe+2H+=Fe2++H2↑; Fe3+>Cu2+>H+>Fe2+.
点评 本题考查氧化还反应的相关知识和离子反应方程式的书写,学生根据强制弱来判断微粒氧化性的强弱,比较容易.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 ,则该有机物核磁共振氢谱有3个峰.
,则该有机物核磁共振氢谱有3个峰.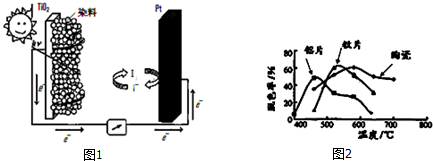
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌是负极,发生还原反应 | B. | 锌是负极,发生氧化反应 | ||
| C. | 铜是负极,发生还原反应 | D. | 铜是负极,发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题


查看答案和解析>>
科目:高中化学 来源: 题型:实验题
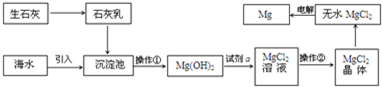
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
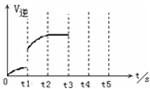 可逆反应Fe(s)+CO2(g)?FeO(s)+CO(g),在温度938K时,平衡常数K=1.47,在1173K时,K=2.15.
可逆反应Fe(s)+CO2(g)?FeO(s)+CO(g),在温度938K时,平衡常数K=1.47,在1173K时,K=2.15.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类在一定条件下都可以水解生成乙醇和二氧化碳 | |
| B. | 乙酸乙酯和油脂都属于酯类物质,碱性条件水解称之为皂化反应 | |
| C. | 硝酸汞溶液加入到鸡蛋清中,可以使蛋清液盐析而沉淀下来 | |
| D. | 淀粉在稀硫酸加热催化下,水解产物葡萄糖的检出,先加入NaOH溶液后加入银氨溶液水浴加热,看是否有银镜出现.若出现银镜,证明有葡糖糖生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com