
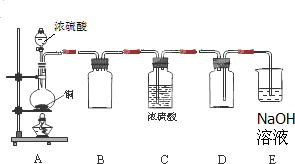
 Na2SO3、SO2是中学常见的物质.
Na2SO3、SO2是中学常见的物质.| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 在试管A中加入少量待测液,加入足量氯水,再加入四氯化碳,振荡,静置后观察颜色. | |
| 步骤② | 在试管B中加入少量待测液, |
有白色沉淀生成, 证明待测液中含SO42-. |
| 步骤③ | 在试管C中加入少量待测液,滴加2mol/LHCl至溶液呈酸性,加入几滴 |
证明待测液中含SO32-. |
| ||
| ||
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 溶液分层,下层呈橙红色 | |
| 步骤② | 加入过量的2mol/L盐酸,再滴加1mol/L BaCl2溶液 | |
| 步骤③ | 新制饱和溴水 | 溴水褪色 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、硫酸铝与过量的氨水反应:Al3++4OH-═AlO2-+2H2O | ||||
| B、除去铁粉中的铝:2Al+2NaOH═2NaAlO2+H2↑ | ||||
C、实验室制取Cl2的离子方程式:MnO2+4HCl(浓)
| ||||
D、浓硫酸与铜的反应:Cu+2H2SO4(浓)
|
查看答案和解析>>
科目:高中化学 来源: 题型:

| 条件X | 变量Y | |
| a | 压强 | 反应的平衡常数 |
| b | 温度 | CO的平衡浓度 |
| c | 温度 | N2的体积分数 |
| d | 催化剂 | NO的平衡转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 有A、E、R、X、Y、Z六种前四周期元素,原子序数依次增大,基态A原子的2p轨道处半充满状态,原子的第一电离能E<A,R是地壳中含量最高的金属元素,X原子核外的M层中有三对成对电子,Y为周期表前四周期中电负性最小的元素,Z原子核外电子数为24.
有A、E、R、X、Y、Z六种前四周期元素,原子序数依次增大,基态A原子的2p轨道处半充满状态,原子的第一电离能E<A,R是地壳中含量最高的金属元素,X原子核外的M层中有三对成对电子,Y为周期表前四周期中电负性最小的元素,Z原子核外电子数为24.查看答案和解析>>
科目:高中化学 来源: 题型:
 碳、氮、硫、氯是四种重要的非金属元素.
碳、氮、硫、氯是四种重要的非金属元素.| HClO | HSCN | H2CO3 |
| K=3.2×10-8 | K=0.13 | Kl=4.2×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制一定物质的量浓度的溶液时,若加水超过容量瓶的刻度线,用胶头滴管将多余液体吸出即可 |
| B、用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,则溶液中一定不含有K+ |
| C、用CCl4萃取碘水后分液时,先打开分液漏斗活塞,放出下层液体,再关闭活塞,从漏斗口倒出上层液体 |
| D、检验某溶液中是否含有Fe3+时,可先加入适量的氯水,再滴加硫氰化钾溶液,若溶液变为红色,则说明溶液中一定含有Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com