
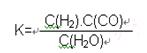
 2CO��g����K1
2CO��g����K1  H2��g��+CO2��g����K2
H2��g��+CO2��g����K2  CO��g��+H2��g����K3
CO��g��+H2��g����K3 H2(g)+CO2(g)���÷�Ӧƽ�ⳣ�����¶ȵı仯���£�
H2(g)+CO2(g)���÷�Ӧƽ�ⳣ�����¶ȵı仯���£�| �¶�/�� | 400 | 500 | 800 |
| ƽ�ⳣ��K | 9.94 | 9 | 1 |
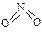 ��
��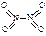 ����֪N��N������Ϊ167kJ��mol��1��NO2�е������ļ���Ϊ466kJ��mol��1��N2O4�е������ļ���Ϊ438.5kJ��mol��1����д��NO2ת��ΪN2O4���Ȼ�ѧ����ʽΪ ��
����֪N��N������Ϊ167kJ��mol��1��NO2�е������ļ���Ϊ466kJ��mol��1��N2O4�е������ļ���Ϊ438.5kJ��mol��1����д��NO2ת��ΪN2O4���Ȼ�ѧ����ʽΪ �� 2NO2(g)�����¶�ΪT1
2NO2(g)�����¶�ΪT1 ��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ��
��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ��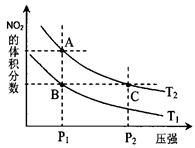
 ��ķ�Ӧ���ʣ�A��C
��ķ�Ӧ���ʣ�A��C  ������״Ԫ��ҵϵ�д�
������״Ԫ��ҵϵ�д� ��ʱ�ƿ�������ϰϵ�д�
��ʱ�ƿ�������ϰϵ�д� һ��һ��һ��ͨϵ�д�
һ��һ��һ��ͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
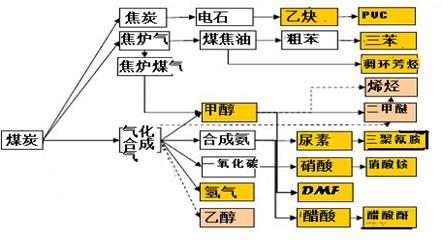
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
 Si3N4��s��+6CO��g��
Si3N4��s��+6CO��g��| ʱ��/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| N2Ũ��/mol��L-1 | 4��00 | 3��70 | 3��50 | 3��36 | 3��26 | 3��18 | 3��10 | 3��00 | 3��00 | 3��00 |
| COŨ��/mol��L-1 | 0��00 | 0��90 | 1��50 | 1��92 | 2��22 | 2��46 | 2��70 | | | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 C(g)��D(g)���仯ѧƽ�ⳣ��K���¶ȱ仯�Ĺ�ϵ���±���ʾ���������й��ж���ȷ����
C(g)��D(g)���仯ѧƽ�ⳣ��K���¶ȱ仯�Ĺ�ϵ���±���ʾ���������й��ж���ȷ����| T/�� | 800 | 850 | 1 000 | 1 200 |
| K | 0��9 | 1��0 | 1��7 | 2��4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ˮ�м�������ʹˮ�ĵ���ƽ�������ƶ���ˮ�����ӻ����� |
| B��NH3(g)��HCl(g)==NH4Cl(s)��H��0������һ���¶��Է�������һ���¶ȷ��Է� |
| C��Ǧ�����ڷŵ�����У������������٣������������� |
| D���ñ���Na2CO3��Һ����BaSO4�������ɽ�BaSO4ת��ΪBaCO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
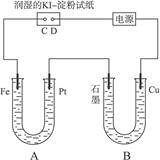
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���������� |
| B��ͭ���Ϸ�����ԭ��Ӧ |
| C�������������� |
| D�����������������·����ͭ�� |
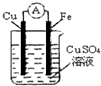
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 ���NOx������������Ͷ�����̼���������ɻ�����Ⱦ����ȼú���������������������̼�ȴ�������ʵ����ɫ���������ܼ��š��������õ�Ŀ�ġ�
���NOx������������Ͷ�����̼���������ɻ�����Ⱦ����ȼú���������������������̼�ȴ�������ʵ����ɫ���������ܼ��š��������õ�Ŀ�ġ� O��g����H2����1160 kJ��mol��1
O��g����H2����1160 kJ��mol��1 ��2����̼����CO2ת��Ϊ�״����Ȼ�ѧ����ʽΪ��
��2����̼����CO2ת��Ϊ�״����Ȼ�ѧ����ʽΪ��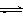 CH3OH��g����H2O��g�� ��H3
CH3OH��g����H2O��g�� ��H3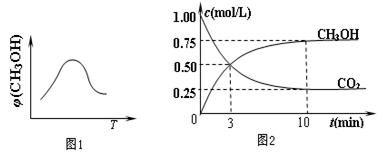
 ���г���1 mol CO2��3 mol H2������������Ӧ�����CO2��CH3OH��g����Ũ����ʱ��仯��ͼ2��ʾ������˵����ȷ���� ������ĸ���ţ���
���г���1 mol CO2��3 mol H2������������Ӧ�����CO2��CH3OH��g����Ũ����ʱ��仯��ͼ2��ʾ������˵����ȷ���� ������ĸ���ţ���| A����10 min������������ٳ���1 mol CO2��3 mol H2�����ٴδﵽƽ��ʱc��CH3OH��="1.5" mol/L |
| B��0~10 min�ڣ�������ƽ����Ӧ����Ϊ0.075 mol/��L��min�� |
| C���ﵽƽ��ʱ��������ת����Ϊ0.75 |
| D�������¶Ƚ�ʹn��CH3OH��/n��CO2����С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ڴ��������װ��ͭ��ɷ�ֹ�䷢���绯ѧ��ʴ |
| B��MnO2��FeCl3��CuSO4���ɼӿ�H2O2�ķֽ����� |
| C��FeCl3��Һ��Fe2(SO4)3��Һ�������ɡ����ն��õ�Fe2O3 |
| D���ö��Ե缫�ֱ���CuCl2��Һ��MgCl2��Һ�ֱ�õ�����Cu��Mg |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ⶨHCl��NaOH���к���ʱ��ÿ��ʵ���Ӧ���������¶ȣ���������ʼ�¶ȡ�NaOH��ʼ�¶Ⱥͷ�Ӧ�����ֹ�¶� |
| B���ɡ�C��ʯī��=C�����ʯ������H=" +119" kJ/mol ����֪���ʯ��ʯī�ȶ� |
| C����ϡ��Һ�У� H+��OH����H2O����H����57.3kJ/mol��������0.5molH2SO4��Ũ�����뺬1molNaOH����Һ��ϣ��ų�����������57.3kJ |
| D����101kPaʱ��2gH2��ȫȼ������Һ̬ˮ���ų�285.8kJ����������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ��2H2(g)+O2(g)=2H2O(l)����H= +285.8kJ/mol |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com