
【题目】二氧化锰不仅是活性好的催化剂,也被广泛用作干电池的正极材料。某化学小组设计用高硫锰矿(主要成分为锰的化合物和硫化亚铁)为原料制取二氧化锰的工艺流程如图:
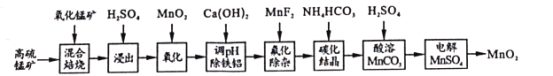
已知:①“混合焙烧”后的烧渣含MnSO4、Fe2O3及少量FeO、MgO、Al2O3
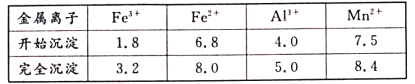
②在该条件下,金属离子开始沉淀和完全沉淀的pH如下表。
(1)写出浸出时与铝元素有关的离子反应方程式__。
(2)上述“氧化”步骤是否可省略__(填“是”或“否”),你的依据是__。
(3)“调pH除铁铝’’时,生成沉淀的pH范围为__;“氟化除杂”中除去的离子为__。
(4)请用平衡移动原理解释除杂处理后的Mn2+用NH4HCO3转化成MnCO3沉淀的过程__(用文字和离子方程式表达)。
(5)用惰性电极电解MnSO4制备MnO2时,其阳极反应式为__;整个流程中能够循环利用的物质除MnO2外还有__(写名称)。
【答案】Al2O3+6H+=2Al3++3H2O 否 若不进行氧化,则Fe2+被完全沉淀的pH为8.0,此时Mn2+也会部分被沉淀下来造成损失 5.0≤pH<7.5 Ca2+、Mg2+ 加入NH4HCO3后,Mn2+与HCO![]() 电离出的CO
电离出的CO![]() 生成MnCO3,HCO
生成MnCO3,HCO![]()
![]() CO
CO![]() +H+、Mn2++CO
+H+、Mn2++CO![]()
![]() MnCO3,HCO
MnCO3,HCO![]() 电离出H+与另一部分HCO
电离出H+与另一部分HCO![]() 反应生成H2O和CO2,促进上述两个平衡正向移动,从而生成MnCO3沉淀 Mn2+-2e-+2H2O=MnO2+4H+ 硫酸
反应生成H2O和CO2,促进上述两个平衡正向移动,从而生成MnCO3沉淀 Mn2+-2e-+2H2O=MnO2+4H+ 硫酸
【解析】
高硫锰矿(主要成分为含锰化合物及FeS)与氧化锰矿混合焙烧,得到MnSO4、Fe2O3及少量FeO、Al2O3、MgO,加入硫酸,得到Mn2+、Fe2+、Fe3+、Mg2+、Al3+的酸性溶液,加入二氧化锰将亚铁离子氧化为铁离子便于除去,再加入氢氧化钙中和,将铁离子与铝离子以氢氧化物的形式除去,加入MnF2除杂,使溶液中的Ca2+、Mg2+沉淀完全,此时溶液中的金属离子为锰离子,加入碳酸氢铵发生Mn2++2HCO3-=MnCO3↓+CO2↑+H2O,加入硫酸溶解MnCO3得到MnSO4溶液,电解MnSO4溶液得到MnO2和硫酸,硫酸和MnO2可循环利用。
(1)浸出时与铝元素有关的离子反应,氧化铝溶于酸生成铝盐和水,离子方程式为Al2O3+6H+=2Al3++3H2O。故答案为:Al2O3+6H+=2Al3++3H2O;
(2)上述“氧化”步骤不可以省略,依据是若不进行氧化,则Fe2+被完全沉淀的pH为8.0,此时Mn2+也会部分被沉淀下来造成损失。故答案为:否;若不进行氧化,则Fe2+被完全沉淀的pH为8.0,此时Mn2+也会部分被沉淀下来造成损失;
(3)“调pH除铁铝’’时,让铝沉淀完全时pH=5,而锰不沉淀时pH小于7.5,生成沉淀的pH范围为5.0≤pH<7.5;CaF2、MgF2难溶于水,“氟化除杂”中除去的离子为Ca2+、Mg2+。故答案为:5.0≤pH<7.5;Ca2+、Mg2+;
(4)用平衡移动原理解释除杂处理后的Mn2+用NH4HCO3转化成MnCO3沉淀的过程:加入NH4HCO3后,Mn2+与HCO![]() 电离出的CO
电离出的CO![]() 生成MnCO3,HCO
生成MnCO3,HCO![]()
![]() CO
CO![]() +H+、Mn2++CO
+H+、Mn2++CO![]()
![]() MnCO3,HCO
MnCO3,HCO![]() 电离出H+与另一部分HCO
电离出H+与另一部分HCO![]() 反应生成H2O和CO2,促进上述两个平衡正向移动,从而生成MnCO3沉淀。故答案为:加入NH4HCO3后,Mn2+与HCO
反应生成H2O和CO2,促进上述两个平衡正向移动,从而生成MnCO3沉淀。故答案为:加入NH4HCO3后,Mn2+与HCO![]() 电离出的CO
电离出的CO![]() 生成MnCO3,HCO
生成MnCO3,HCO![]()
![]() CO
CO![]() +H+、Mn2++CO
+H+、Mn2++CO![]()
![]() MnCO3,HCO
MnCO3,HCO![]() 电离出H+与另一部分HCO
电离出H+与另一部分HCO![]() 反应生成H2O和CO2,促进上述两个平衡正向移动,从而生成MnCO3沉淀;
反应生成H2O和CO2,促进上述两个平衡正向移动,从而生成MnCO3沉淀;
(5)用惰性电极电解MnSO4制备MnO2时,电解过程中阳极发生氧化反应,元素化合价升高,故为硫酸锰失去电子生成二氧化锰和硫酸,其阳极反应式为Mn2+-2e-+2H2O=MnO2+4H+;整个流程中能够循环利用的物质除MnO2外还有硫酸。故答案为:Mn2+-2e-+2H2O=MnO2+4H+;硫酸。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,22.4 LCC14中含CC14的分子数为NA
B.0.1 mol/L的NaOH溶液中含OH-的数目为0.INA
C.5.6 g Fe在0.1 mol Cl2中充分燃烧时转移的电子数为0.3NA
D.23 g钠在空气中充分燃烧时转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是
A. 工业制硫酸采用二氧化硫催化氧化,高温可以提高单位时间SO3的产量
B. 合成氨工业中使用铁触媒做催化剂
C. 用饱和食盐水除去氯气中氯化氢杂质
D. 容器中有2NO2![]() N2O4,增大压强颜色变深
N2O4,增大压强颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300℃以上完全分解; ②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险; ④受热或遇水分解放热,放出腐蚀性烟气; | ||||
(1)制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品。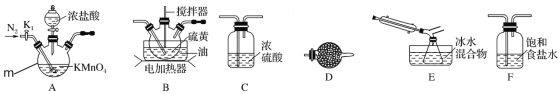
①仪器m的名称为___,装置F中试剂的作用是___。
②装置连接顺序:A→___→E→D。
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是___。
④为了提高S2Cl2的纯度,实验的关键是控制好温度和___。
(2)①S2Cl2遇水强烈反应产生烟雾,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原状,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式___。
②甲同学为了验证两种气体产物,将水解生成的气体依次通过硝酸银与稀硝酸的混合溶液、品红溶液、NaOH 溶液,该方案___(填“可行”或“不可行”),原因是___。
(3)某同学为了测定S2Cl2与水反应后生成的气体X在混合气体中的体积分数,设计了如下实验方案:
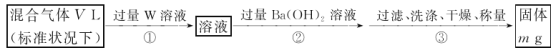
①W溶液可以是___(填标号)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中气体X的体积分数为____(用含V、m的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组向一定量的NaHSO3溶液(加入少量淀粉)中加入稍过量的KIO3 溶液,一段时![]() 间后,溶液突然变蓝色。为进一步研究有关因素对反应速率的影响,探究如下。
间后,溶液突然变蓝色。为进一步研究有关因素对反应速率的影响,探究如下。
(1)查阅资料 知NaHSO3与过量KIO3反应分为两步进行,且其反应速率主要由第一步反应决定。已知第一步反应的离子方程式为IO3—+3HSO3—===3SO42—+I—+3H+,则第二步反应的离子方程式为________________。
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如下。
编号 | 0.01mol/LNaHSO3溶液/mL | 0.01mol/L KIO3 溶液/mL | H2O/mL | 反应温度 /℃ | 溶液变蓝所用时间t/s |
① | 6.0 | 10.0 | 4.0 | 15 | t1 |
② | 6.0 | 14.0 | 0 | 15 | t2 |
③ | 6.0 | a | b | 25 | t3 |
实验①②是探究_______________对反应速率的影响,表中t1___________t2(填“>”、“=”或“<”);
实验①③是探究温度对反应速率的影响,表中a=_____________,b=_____________。、
(3)将NaHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段反应速率 逐渐增大。该小组对其原因提出如下假设,请你完成假设二。
假设一:生成的SO42—对反应起催化作用;
假设二:___________________________;……
(4)请你设计实验验证上述假设一,完成下表中内容。
实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率v(甲) 在烧杯乙中先加入少量①_____,其他条件与甲完全相同,用速率检测仪测定起始时的反应速率v(乙) | ②若v(甲)___v(乙),则假设一不成立 ③若v(甲)___v(乙),则假设一成立 (填“>”、“=”或“<”) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水溴化镁常常做催化剂。选用如图所示装置(夹持装置略)采用镁屑与液溴为原料制备无水MgBr2。
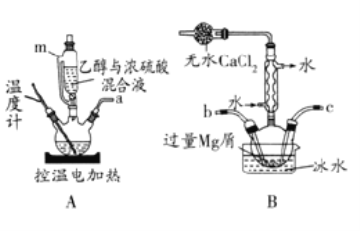
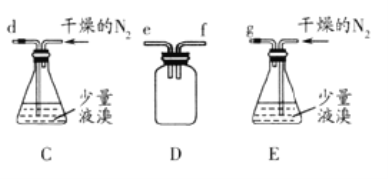
已知:
(1)乙醚的熔点为34.6℃,沸点为132℃。
(2)Mg和Br2剧烈反应,放出大量的热;MgBr2具有强吸水性;MgBr2能与乙醚发生反应MgBr2+3C2H5OC2H5→MgBr23C2H5OC2H5。
实验主要步骤如下:
Ⅰ.选用上述部分装置,正确连接,检查装置的气密性。向装置中加入药品。
Ⅱ.加热装置A,迅速升温至140℃,并保持140℃加热一段时间,停止加热。
Ⅲ.通入干燥的氮气,让液溴缓慢进入装置B中,直至完全加入。
IV.装置B中反应完毕后恢复至室温,过滤反应物,将得到的滤液转移至干燥的烧瓶中,在冰水中冷却,析出晶体,再过滤得三乙醚合溴化镁粗产品。
V.用苯洗涤粗产品,减压过滤,得三乙醚合溴化镁,将其加热至160℃分解得无水MgBr2。回答下列问题:
(1)步骤I中所选装置的正确连接顺序是a___(填小写字母)。装置D的作用是___。
(2)装置A中使用仪器m的优点是___。
(3)若加热装置A一段时间后发现忘记加入碎瓷片,应该采取的正确操作是___。
(4)步骤V中用苯洗涤三乙醚合溴化镁的目的是___。
(5)步骤V采用减压过滤(使容器内压强降低,以达到固液快速分离)。下列装置可用作减压过滤的是___(填序号)。
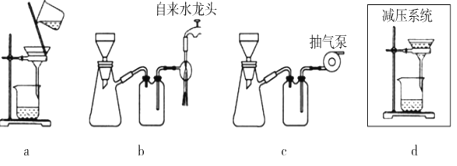
(6)实验中若温度控制不当,装置B中会产生CH2Br—CH2Br。请说明原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品保鲜膜按材质分别为聚乙烯 (PE )、聚氯乙烯 (PVC )、聚偏二氯乙烯 (PVDC )等种类。 其中 PE 和 PVDC 是安全的。PVC 对人体的潜在危害主要来源于两个方面:产品中氯乙烯单体残留量、加工过程中使用的加工助剂的种类及含量。
(1)写出用乙烯、氯乙烯分别生产聚乙烯和聚氯乙烯的化学方程式:乙烯→聚乙烯 (PE ):_____ 氯乙烯→聚氯乙烯 (PVC ):_____ 日常用的食品保鲜膜宜选用_____。
(2)目前出现的“不粘锅”、不粘油的吸油烟机等新型厨具,其秘密就是表面有一种叫做“特富龙”的涂层,实际上就是被称为“塑料王”的聚四氟乙烯。它的单体四氟乙烯的结构简式是_____,合成特富龙的反应类型是_____,反应方程式为_____。
(3)聚四氟乙烯的发现源于一次实验意外。1938 年,化学家普鲁凯特与助手们研究四氟乙烯的聚合反应,他们将四氟乙烯贮存在冷藏箱中的加压钢瓶中,当将钢瓶与反应器管道、反应器 (管道 及反应器间隙有空气 )接通后,发生故障,四氟乙烯气体并没有通到反应器中,经称重证明钢瓶中气体一点没减少,打开阀门也没有四氟乙烯气体逸出,但拆卸阀门后却从钢瓶倒出与四氟乙烯等重的白色粉末,即四氟乙烯已在钢瓶中发生了聚合反应。后经确证,该白色粉末就是聚四氟乙烯。1945 年,美国杜邦公司开始在工业规模上生产聚四氟乙烯,由此可以推知该反应的条件是_____、_____、_____引发。
(4 )不粘锅的内壁有一薄层聚四氟乙烯涂层,因此用不粘锅烧饭菜时不易粘锅,下列说法正确的是_____
a.聚四氟乙烯分子中没有双键
b.聚四氟乙烯的单体是不饱和烃
c.聚四氟乙烯的化学性质很不活泼
d.聚四氟乙烯的熔沸点很低
乙炔是一种重要的基本有机原料,在一定条件下其衍变关系如图:

已知:B 是一种塑料,75%的 D 溶液在医药上用作消毒剂。试回答下列问题:
(5)比乙炔多一个碳原子的同系物的结构简式是_____。
(6)A 物质的结构简式是_____,A→B 反应类型是_____反应。
(7)出以下各步反应的化学方程式:乙炔→A:_____ 乙炔→C:_____ C→D:_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是一种性能非常优越的金属,21世纪将是钛的世纪。
(1)TiO2薄膜中掺杂铬能显著提高光催化活性。基态Cr原子的核外电子排布式为____。
(2)四乙醇钛能增加橡胶在金属表面的粘附性。其制备原理如下:TiCl4+4CH3CH2OH+4NH3=Ti(OCH2CH3)4+4NH4Cl
①Ti(OCH2CH3)4可溶于有机溶剂,常温下为淡黄色透明液体,其晶体类型为____
②N和O位于同一周期,O的第二电离能大于N的第二电离能的原因是_____;
③NH4Cl中存在的作用力有_____,NH4Cl熔沸点高于CH3CH2OH的原因是_____,Ti(OCH2CH3)4分子中C原子的杂化形式均为 ____。
(3)钛酸锶(SrTiO3)可作电子陶瓷材料和人造宝石,其中一种晶胞结构如图所示。若Ti位于顶点位置,O位于____位置;已知晶胞参数为a nm,Ti位于O所形成的正八面体的体心,则该八面体的边长为_____ m(列出表达式)。
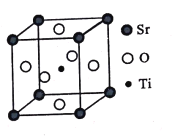
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学内容回答下列问题:
(1)基态硼原子电子排布图为__________________。
(2)根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的一组是_____。
A.SO![]() 和NO
和NO![]() B.NO
B.NO![]() 和SO3 C.H3O+和ClO
和SO3 C.H3O+和ClO![]() D.PO
D.PO![]() 和SO
和SO![]()
(3)第三周期某元素的前5个电子的电离能如图1所示。该元素是_____(填元素符号),判断依据是_ ______________。
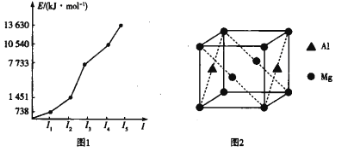
(4)铝镁合金是优质储钠材料,原子位于面心和顶点,其晶胞如图2所示。1个铝原子周围有_____________个镁原子最近且等距离。
(5) 配合物Fe(CO)5的熔点-20℃,沸点103℃,可用于制备纯铁。Fe(CO)5的结构如下图所示。下列关于Fe(CO)5说法不正确的是________。

A.Fe(CO)5是非极性分子,CO是极性分子
B.Fe(CO)5中Fe原子的配体与C22-互为等电子体
C.1mol Fe(CO)5含有5mol![]() 键
键
D.Fe(CO)5=Fe+5CO反应中没有新化学键生成
(6)独立的NH3分子中,H—N—H键键角为107°18’。如图是[Zn(NH3)6]2+的部分结构以及其中H—N—H键键角。
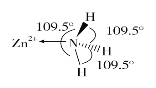
请解释[Zn(NH3)6]2+离子中H—N—H键角变为109.5°的原因是____________________________________________________________。
(7)已知立方BN晶体硬度很大,其原因是________;其晶胞结构如图所示,设晶胞中最近的B、N原子之间的距离为a nm,阿伏加德罗常数的值为NA,则晶体的密度为_____g·cm-3(列式即可,用含a、NA的代数式表示)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com