
| 紫外线 |
| A、单位时间内生成2 mol O3,同时消耗3 mol O2 |
| B、O2的消耗速率0.3 mol?L-1?s-1,O3的消耗速率0.2 mol?L-1?s-1 |
| C、容器内,2种气体O3、O2浓度相等 |
| D、气体的密度不在改变. |


科目:高中化学 来源: 题型:
| A、在一定条件下,催化分解80 g SO3所得混合气体中氧原子数为3NA |
| B、一定条件下,铁与水蒸气反应生成8.96L(已折合成标准状况)H2时,转移的电子数为0.8NA |
| C、将100mL1mol/L AlCl3与100mL3mol/L NaCl溶液混合后,Cl-的个数为0.6NA |
| D、含有非极性键的数目为NA的Na2O2与水充分反应产生标准状况下22.4LO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
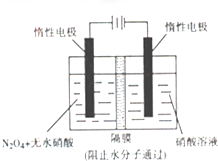
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若用标准状况下4.48LCH4还原NO2生成N2和水蒸气,放出的热量为173.4 kJ |
| B、由反应①可推知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H<-574 kJ?mol-1 |
| C、反应①②转移的电子数不同 |
| D、反应①②均为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

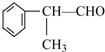
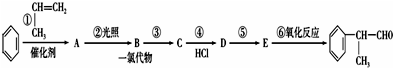
查看答案和解析>>
科目:高中化学 来源: 题型:

| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com