
| 实验方案 | 实验现象 |
| 1.用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞 2.向新制的H2S饱和溶液中滴加氯水 3.钠与滴有酚酞试液的冷水反应 4.镁带与2mol/L的盐酸反应 5.铝条与2mol/L的盐酸反应 6.向AlCl3溶液中滴加NaOH溶液至过量 | A.浮于水面,熔成小球,四处游动,逐渐缩小,溶液变红色 B.产生大量气体,气体可燃,溶液变浅红色 C.反应不十分强烈,产生的气体可燃 D.剧烈反应,产生的气体可燃 E.生成白色絮状沉淀,继而沉淀消失 F.生成淡黄色沉淀 |
| 实验方案 | 实验现象 | 有关离子方程式 |
| A | ||
| B | 不 填 | |
| C | 不 填 | |
| D | 不 填 | |
| E | ||
| F |
| 实验方案 | 实验现象 | 有关离子方程式 |
| 3 | A | 2Na+2H2O=2Na++2OH-+H2↑ |
| 1 | B | |
| 4 | ||
| 5 | ||
| 6 | E | Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O |
| 2 | F | H2S+Cl2=2H++2Cl-+S↓ |


科目:高中化学 来源: 题型:
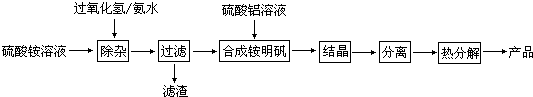
查看答案和解析>>
科目:高中化学 来源: 题型:
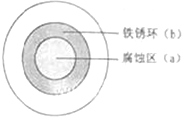
| A、液滴中的Cl-由a 区向b区迁移 |
| B、液滴边缘区发生的电极反应为:2H++2e-=H2 |
| C、液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a 区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈 |
| D、导致该现象的主要原因是液滴之下氧气含量比边缘处少. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 丁 |
| 丁 |
| 甲 |
| A、若甲为焦炭,则丁可能是O2 |
| B、若甲为NaAlO2,则丁可能是盐酸 |
| C、若甲为NaOH溶液,则丁可能是CO2 |
| D、若甲为Fe,则丁可能是盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验现象 | 结论 | |
| 实验① | ||
| 实验② |
查看答案和解析>>
科目:高中化学 来源: 题型:
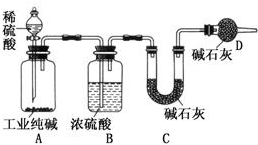 工业纯碱中常含有NaCl、Na2SO4等杂质,为了测定工业纯碱中Na2CO3的含量,某同学设计了如图装置:
工业纯碱中常含有NaCl、Na2SO4等杂质,为了测定工业纯碱中Na2CO3的含量,某同学设计了如图装置:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合成氨工业中,将NH3及时液化分离有利于加快反应速率 |
| B、硫酸工业中,接触室内安装热交换器是为了利用SO3转化为H2SO4时放出的热量 |
| C、氯碱工业中,使用离子交换膜可防止C12和NaOH溶液反应 |
| D、电镀工业中,必需将镀件与电源的负极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:
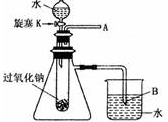 用脱脂棉包住约0.2g过氧化钠固体粉末,置于石棉网上,然后向包有过氧化钠的位置滴加几滴水,结果脱脂棉剧烈燃烧起来.
用脱脂棉包住约0.2g过氧化钠固体粉末,置于石棉网上,然后向包有过氧化钠的位置滴加几滴水,结果脱脂棉剧烈燃烧起来.查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
A、
| ||
B、
| ||
| C、7 | ||
D、
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com