
将一定量的锌与100 mL 18.5 mol·L-1浓硫酸充分反应后,锌完全溶解,同时生成气体A 16.8 L(标准状况)。将反应后的溶液稀释到1 L,测得溶液的pH=0,则下列叙述中错误的是( )
A.气体A为S O2和H2
O2和H2 的混合物
的混合物
B.气体A中SO2和H2的体积比为4∶1
C.反应中共消耗锌97.5 g
D.反应中共转移电子1.5 mol
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
NH3和纯净的O2在一定条件下发生反应:4NH3(g)+3O2(g)  2N2(g)+6H2O(g),现向一
2N2(g)+6H2O(g),现向一
容积不变的2 L密闭容器中充入4 mol NH3和3 mol O2,4 min后,测得生成的H2O占混合气体体积的40%,
则下列表示此段时间内该反应的平均速率不正确的是( )
A.v(N2)=0.125 mol·L-1·min-1
B.v(H2O)=0.375 mol·L-1·min-1
C.v(O2)=0.225 mol·L-1·min-1
D.v(NH3)=0.250 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
将7 g某铜、银合金与足量的a mol·L-1 HNO3充分反应,完全溶解后放出的气体与标准状况下的氧气0.56 L混合,通入水中恰好完全吸收,则此合金中铜的质量是( )
A.1.6 g B.2.4 g
C.3.2 g D.4.8 g
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质的性质和该性质的应用均正确的是
A.氯气具有酸性,可与烧碱或石灰乳反应制备含氯消毒剂
B.浓硫酸具有强氧化性,常温下可用铝罐盛装
C.氢氟酸具有弱酸性,可用氢氟酸雕刻玻璃
D.过氧化钠具有强氧化性,可用作潜水艇中氧气的来源
查看答案和解析>>
科目:高中化学 来源: 题型:
利用下列试剂,选用合适方法鉴别Na2SO4、Na2SO3、Na2CO3、NaCl四种溶液,最佳试剂组是( )
A.BaCl2、HCl、品红溶液 B.BaCl2、HCl、石蕊试液
C.AgNO3和HNO3溶液 D.AgNO3和BaCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化合物的俗称与化学式不对应的是
A.绿矾-FeSO4·7H2O B.芒硝-Na2SO4·10H2O
C.明矾- Al2(SO4)3·12H2O D.胆矾- CuSO4·5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
两种盐的固体混合物:①加热时 有气体产生,②加水溶解时有沉淀生成,且沉淀溶于稀盐酸。满足上述条件的混合物是 ( )
有气体产生,②加水溶解时有沉淀生成,且沉淀溶于稀盐酸。满足上述条件的混合物是 ( )
A.BaCl2和(NH4)2SO3 B.AaNO3和NH4Cl
C.FeCl3和NaHCO3 D.KCl和Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列根据实验操作和现象所得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向鸡蛋白溶液中滴入HgCl2溶液 | 有白色沉淀 | 蛋白质发生盐析 |
| B | 向溶液X中滴加BaCl2溶液 | 有白色沉淀 | X中一定含有SO42- |
| C | AgCl饱和溶液中加入少量NaI溶液 | 产生黄色沉淀 | Ksp(AgI)>Ksp(AgCl) |
| D | 向加入了几滴酚酞试液的Na2CO3溶液中滴加BaCl2溶液 | 红色逐渐退去 | Na2CO3溶液中存在水解平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【理综卷·2015届重庆市重庆一中高三上学期第一次月考(201409)】2.(共13分)氯碱工业是最基本的化学工业之一,其主要原理基于电解饱和食盐水:2NaCl+2H2O 2NaOH+H2↑+Cl2↑,它的产品烧碱和氯气以及氢气应用广泛。请回答下列问题:
2NaOH+H2↑+Cl2↑,它的产品烧碱和氯气以及氢气应用广泛。请回答下列问题:
(1)电解前,如果粗盐中SO42- 含量较高,必须添加钡试剂除去SO42- ,该钡试剂可以是______________(填字母代号)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(2)“盐泥”是电解食盐水过程中形成的工业“废料”。某工厂的盐泥组成如下:
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶物 |
| 质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |
利用盐泥生产MgSO4·7H2O晶体的工艺流程如下图所示。
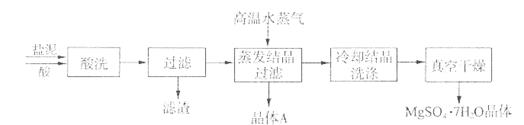
回答下列问题:
①酸洗过程中加入适量硫酸控制pH为5左右,反应温度在50℃左右。持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,CaCO3在此过程中转化为CaSO4,请解释此转化得以发生的原因 。
②过滤所得滤渣的主要成分为 。
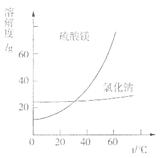
③根据下图分析,蒸发结晶过滤所得晶体A主要成分为 。
④真空干燥MgSO4·7H2O晶体的原因是 。
(3)已知NaCl在60 ℃的溶解度为37.1 g,现电解60 ℃精制饱和食盐水1371 g,经分析,电解后溶液密度为1.37 g·cm-3,其中含有20 g NaCl,则电解后NaOH的物质的量浓度为________________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com