
下列叙述正确的是
A.等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多
B.稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
C.C(石墨,s)=C(金刚石,s) ΔH=+1.9 kJ·mol-1,则说明金刚石比石墨稳定
D.反应2CO(g)+2NO(g)  N2(g)+2CO2(g)在298 K时能自发进行,则它的,ΔS>0
N2(g)+2CO2(g)在298 K时能自发进行,则它的,ΔS>0
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源:2014-2015学年广东省六校联盟高三第三次联考理科综合化学试卷(解析版) 题型:填空题
(16分)I.合成氨的原料气H2可通过反应CO(g)+H2O(g)  CO2 (g) +H2(g)获取。
CO2 (g) +H2(g)获取。
(1)T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为 ,该温度下反应的平衡常数K值为 。
(2)保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入固定容器中进行反应,下列描述能够说明体系处于平衡状态的是 (填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n (CO) : n (H2O) : n (CO2) : n (H2) = 1 : 16 : 6 : 6
II.(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧实验中相关的反应有:
①4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H1
②4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H2
③4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H3
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1= 。
(2)美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置用铂作为电极、加入碱性电解质溶液,其电池反应为 4NH3+3O2=2N2+6H2O
①写出该燃料电池的正极反应式 。
②若用该燃料电池产生的电能在铁皮上镀锌(制白铁皮),某铁皮上现需要镀上9.75g锌,理论上至少需要消耗标准状况的氨气 L。
III.(1)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。由图可知Mg与卤素单质的反应均为 (填“放热”或“吸热”)反应。
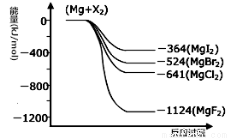
(2)金属Mg与CH3Cl在一定条件下反应可生成CH3MgCl,CH3MgCl是一种重要的有机合成试剂,易与水发生水解反应并有无色无味气体和沉淀生成。写出CH3MgCl水解的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省上饶市高三上学期第一次联考化学试卷(解析版) 题型:选择题
FeCl3溶液与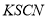 溶液混合,发生反应:Fe3+(aq)+3SCN-(aq)=Fe(SCN)3(aq) △H,其中
溶液混合,发生反应:Fe3+(aq)+3SCN-(aq)=Fe(SCN)3(aq) △H,其中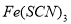 的浓度与温度
的浓度与温度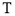 的关系如图所示,下列说法正确的是
的关系如图所示,下列说法正确的是
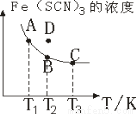
A.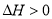
B.反应处于D点时,一定有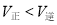
C.溶液中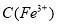 :A点>B点
:A点>B点
D.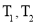 时相应的平衡常数分别为
时相应的平衡常数分别为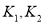 则
则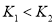
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省无锡市高三期末考试化学试卷(解析版) 题型:实验题
B.[实验化学]
实验室用乙酸和正丁醇制备乙酸正丁酯。有关物质的相关数据如下表。
化合物 | 相对分子质量 | 密度/g·cm-3 | 沸点/℃ | 溶解度/100 g水 |
正丁醇 | 74 | 0.80 | 118.0 | 9 |
冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
请回答有关问题。
Ⅰ.乙酸正丁酯粗产品的制备在三颈圆底烧瓶中进行,并使用了分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管。实验需要的药品:浓硫酸、冰醋酸和正丁醇。
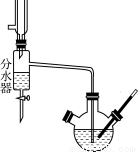
(1)有同学拟通过核磁共振氢谱鉴定所得产物中是否含有正丁醇,正丁醇的氢谱线中的几个峰的面积之比是________。
(2)反应前三颈圆底烧瓶中先加人适量沸石,然后依次加入________。
(3)分水器的作用________。
Ⅱ.乙酸正丁酯粗产品的精制。
(1)将三颈圆底烧瓶中的液体转入分液漏斗中,并用________洗涤有机层,用分液法分离上述有机层和水层,分液完成后,取出有机层的操作是________。
(2)将酯层进行蒸馏。蒸馏收集乙酸正丁酯产品。
Ⅲ.计算产率
如果实验中加入了18.5 mL正丁醇、15.4 mL冰醋酸和2 mL浓硫酸,实验后制得的乙酸正丁酯的质量为12.76 g,则乙酸正丁酯的产率为________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省无锡市高三期末考试化学试卷(解析版) 题型:选择题
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:
A(g)+xB(g) 2C(g) ΔH=a kJ·mol-1
2C(g) ΔH=a kJ·mol-1
各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如下表和下图:
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | 1.0 L |
温度/℃ | T1 | T2 | T2 |
反应物 起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |
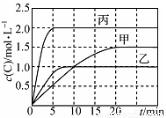
下列说法不正确的是
A.10 min内甲容器中反应的平均速率v(A)=0.10 mol·L-1·min-1
B.其他条件不变,甲容器中在20 min后,降低温度,平衡向正反应方向移动
C.保持其他条件不变,若起始时向乙容器中充入3.0 mol A、1.0 mol B和2.0 mol C,则反应达到新平衡前v(逆)>v(正)
D.T2 ℃,向丙容器的平衡体系中再充入1.5 mol A、0.5 mol B,平衡时C的体积分数大于25%
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省无锡市高三期末考试化学试卷(解析版) 题型:选择题
下列装置进行的相应实验,能达到实验目的的是
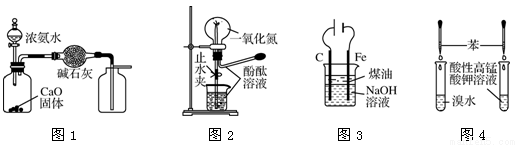
A.用图1装置制取并收集干燥纯净的NH3
B.用图2装置可演示NO的喷泉实验
C.用图3装置制备Fe(OH)2并能较长时间观察其颜色
D.用图4装置验证苯中是否有独立的碳碳双键
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省哈尔滨市高一下学期第一次月考化学试卷(解析版) 题型:填空题
(16分)在氮单质和常见化合物中:
(1)常用作保护气(如填充灯泡、焊接保护等)的物质是 。原因是 。
(2)常用作制冷剂的物质是 ,原因是 。
(3)能与酸反应生成盐、在常温下为气态的物质是 写出它与HCl等强酸反应的离子方程式: 。
(4)在通常状况下是晶体、易溶于水、可以作氮肥、遇碱会放出带刺激性气味气体的物质是 ,写出它们与NaOH等强碱溶液反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省哈尔滨市高一下学期第一次月考化学试卷(解析版) 题型:选择题
一氧化氮对SARS病毒有直接抑制作用.下列关于一氧化氮的叙述正确的是
A.一氧化氮是一种红棕色的气体
B.常温常压下,一氧化氮不能与空气中的氧气直接化合
C.一氧化氮可由氮气和氧气在放电条件下直接化合得到
D.一氧化氮易溶于水,不能用排水法收集
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省宁波市高三十校联考理科综合化学试卷(解析版) 题型:填空题
(共18分)
(Ⅰ)无机盐A是医学上常用的镇静催眠药,由两种元素组成。将其溶于水,通入适量黄绿色气体B,然后向反应后的溶液中加入四氯化碳并振荡、静置,溶液分层,下层液体呈橙红色。分液后取上层溶液,经元素分析,溶质为漂白粉的主要成分之一,往此溶液通入CO2和NH3可获得纳米材料E和铵态氮肥F。
(1)无机盐A中阳离子的结构示意图 。
(2)工业上制取漂白粉的化学反应方程式 。
(3)CO2和NH3两气体中,应该先通入溶液中的是 (填化学式),写出制备E和F的离子反应方程式
(Ⅱ)某研究小组为了探究一种浅绿色盐X(仅含四种元素,不含结晶水,M(X)﹤908 g·mol-1)的组成和性质,设计并完成了如下实验。
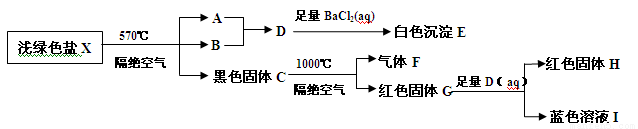
取一定量的浅绿色盐X进行上述实验,充分反应后得到23.3g白色沉淀E、28.8g红色固体G和12.8g红色固体H。
已知:(1)浅绿色盐X在570℃、隔绝空气条件下受热分解为非氧化还原反应。
(2)常温下B呈液态且1个B分子含有10个电子
请回答如下问题:
(1)写出B分子的电子式 。
(2)已知G溶于稀硝酸,溶液变成蓝色,并放出无色气体。请写出该反应的离子方程式为 。
(3)X的化学式是 ,在隔绝空气、570℃温度下加热X至完全分解的化学反应方程式为 。
(4)一定条件下,NH3与黑色固体C发生氧化还原反应得到红色固体和气体丙(丙是大气主要成分之一),写出一个可能的化学反应方程式 ,设计一个实验方案探究 红色固体的成分 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com