
| 反应时间/min | n(CO)/mol | n(H2O)/mol | n(CO2)/mol | n(H2)/mol |
| 0 | 1.20 | 0.60 | 0 | 0 |
| t1 | 0.80 | |||
| t2 | 0.20 |
| A. | 反应在t1min末的速率为v(H2)=0.2/t mol•L-1•min-1 | |
| B. | 平衡时水蒸气的转化率为66.67% | |
| C. | 该温度下反应的平衡常数为l | |
| D. | 其他条件不变,若起始时,n(CO)=0.60 mol,n(H2O)=1.20 mol,则平衡时水蒸气的转化率为33.33% |
分析 A.速率为平均速率,不是瞬时速率;
B.t2时刻一定达到平衡状态,转化率=$\frac{转化的量}{开始的量}$×100%;
C.K为生成物浓度幂之积与反应物浓度幂之积的比,结合平衡浓度计算K;
D.结合K不变及化学平衡三段法计算.
解答 解:A.反应速率只能表示平均速率不能表示瞬时速率,反血在t1min内的平均速率为v(H2)=$\frac{0.2}{{t}_{1}}$mol•L-1•min-1,故A错误;
B.由表中的数据可知t2时刻一定达到平衡状态,则水蒸气的平衡转化率为$\frac{0.6-0.2}{0.6}$×100%=66.67%,故B正确;
C.根据方程式可知K=$\frac{c(C{O}_{2})c({H}_{2})}{c(CO)c({H}_{2}O)}$=$\frac{0.2×0.2}{0.2×0.2}$=1,故C正确;
D.温度不变,平衡常数不变,设水蒸气的转化率为x,则
CO(g)+H2O(g)?CO2(g)+H2(g)
开始 0.6 1.2 0 0
转化1.2x 1.2x 1.2x 1.2x
平衡0.6-1.2x 1.2-1.2x 1.2x 1.2x
$\frac{1.2x×1.2x}{(0.6-1.2x)(1.2-1.2x)}$=1,解得x=33.33%,故D正确;
故选A.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、转化率计算等为解答的关键,侧重分析与计算能力的考查,注意选项A为解答的易错点,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保持体积不变加入H2 | B. | 压缩体积至原来的一半 | ||
| C. | 降低温度 | D. | 加入催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  和 和 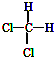 是两种种不同的物质 是两种种不同的物质 | |
| B. | 由乙烯之间的相互加成可以得到聚乙烯 | |
| C. | 丁烷与丁烯互为同系物 | |
| D. | 乙酸不能使紫色石蕊变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
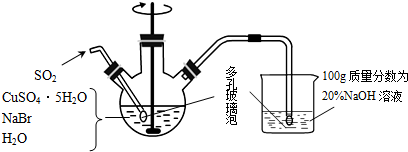
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
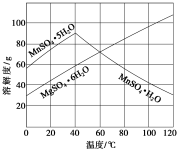 软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2═MnSO4.
软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2═MnSO4.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
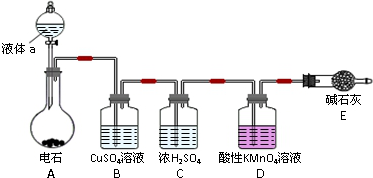
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com