
【题目】在呼吸面具和潜水艇中可用过氧化钠作为供养剂。请选择适当的化学试剂和实验 用品,用下图中的实验装置进行试验,证明过氧化钠可作供养剂。

(1)A是制取CO2的装置。写出A中发生反应的化学方程式:__________________。
(2)填写表中空格:
仪器 | 加入试剂 | 加入试剂的目的 |
B | 饱和NaHCO3溶液 | ____________ |
C | _________________ | ____________ |
D | _________________ | ____________ |
科目:高中化学 来源: 题型:
【题目】绿色能源是指使用过程中不排放或排放极少污染物的能源,如一级能源中的水能、地热、天然气等;二级能源中电能、氢能等。下列能源属于绿色能源的是
①太阳能 ②风能 ③石油 ④煤 ⑤潮汐能 ⑥木材
A. ①②③ B. ③④⑤ C. ④⑤⑥ D. ①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学探究学习小组的同学用下图所示装置制取氯气并探究氯气的某些性质。
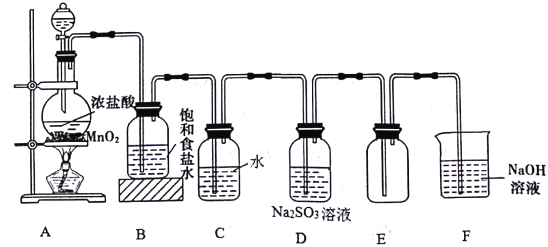
(1)装置A中制取Cl2的化学方程式为________________________。
(2)装置C中发生反应的离子方程式为_________________,反应后溶液中含Cl元素的分子有_________。
(3)实验结束后,测得装置D溶液中存在大量SO42-。Cl2通过装置D溶液时发生反应的离子方程式为 _____________ 。
(4)装置F的作用是______,该装置中发生反应的离子方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-55.6 kJ·mol-1,则HCN在水溶液中电离的ΔH等于
A.-67.7 kJ·mol-1 B.-43.5 kJ·mol-1 C.+43.5 kJ·mol-1 D.+67.7 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性.回答下列问题:
(1)H3PO2与足量的NaOH溶液反应,生成NaH2PO2,则H3PO2为______ 元酸,其电离方程式是__________.
(2)H3PO2是中强酸,写出其与NaHCO3溶液反应的离子方程式______________________.
(3)H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银.
①H3PO2中,P元素的化合价为__________;
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则其氧化产物为_____________;(填化学式)
(4)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应,写出白磷与Ba(OH)2溶液反应的化学方程式____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaN3+KNO3→N2↑+K2O+Na2O此方程式是汽车剧烈碰撞时,安全气囊中发生的反应。对上述反应的描述错误的是( )
A. NaN3是还原剂,KNO3是氧化剂
B. 该反应中有一种元素的化合价发生变化
C. 若生成8 mol N2,则转移电子的物质的量为5 mol
D. 配平后物质的系数依次为10、2、1、5、16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究特点。
已知:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=+206.2 kJ·mol1
CO(g)+3H2(g) ΔH=+206.2 kJ·mol1
CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH=+247.4 kJ·mol1
2CO(g)+2H2(g) ΔH=+247.4 kJ·mol1
2H2S(g)![]() 2H2(g)+S2(g) ΔH=+169.8 kJ·mol1
2H2(g)+S2(g) ΔH=+169.8 kJ·mol1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为____________________________________。
(2)H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是____________;燃烧生成的SO2与H2S进一步反应,生成物在常温下均非气体,写出该反应的化学方程式:
______________________________。
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图所示。图中A、B表示的物质依次是________________________________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com