
分析 (1)铁和氯化铁反应生成氯化亚铁,氯化亚铁溶液中加入铁粉防止氯化亚铁被氧化;
(2)氯气具有氧化性能氧化氯化亚铁为氯化铁;
(3)煤油不溶于水,密度比水小,分层后可以隔离溶液与空气接触,排除氧气对实验的影响;
(4)加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀是亚铁离子的检验特征反应现象,第一支试管中加入1mL CCl4充分振荡、静置,CCl4层显紫色说明生成I2,碘离子被铁离子氧化为碘单质,随浓度变小,碘离子在稀的氯化铁溶液中不发生氧化还原反应.
解答 解:(1)铁和氯化铁反应生成氯化亚铁,在FeCl2溶液中需加入少量铁屑,其目的是防止氯化亚铁被氧化,
故答案为:防止氯化亚铁被氧化;
(2)氯气具有氧化性能氧化氯化亚铁为氯化铁,反应的离子方程式为:Cl2+2Fe2+=2Fe3++2Cl-,
故答案为:Cl2+2Fe2+=2Fe3++2Cl-;
(3)煤油不溶于水,密度比水小,分层后可以隔离溶液与空气接触,排除氧气对实验的影响,
故答案为:隔离空气(排除氧气对实验的影响);
(4)加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀是亚铁离子的检验特征反应现象,实验②检验的离子是Fe2+,①第一支试管中加入1mL CCl4充分振荡、静置,CCl4层显紫色说明生成I2,碘离子被铁离子氧化为碘单质,反应的离子方程式为:Cl2+2Fe2+=2Fe3++2Cl-,③第三支试管中加入1滴KSCN溶液,溶液变红,说明随浓度变小,碘离子在稀的氯化铁溶液中不发生氧化还原反应,仍含有铁离子,在I-过量的情况下,溶液中仍含有Fe3+,说明该反应为可逆反应.
故答案为:Fe2+;Fe3+;可逆反应.
点评 本题考查了铁架化合物性质、主要是溶液配制、离子方程式书写、离子检验、盐类水解等知识点,注意题干信息的分析判断,题目难度中等.


科目:高中化学 来源: 题型:实验题

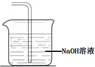 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
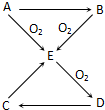 已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),
已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 玻璃是混合物 | |
| B. | 制造玻璃的原料是纯碱、石灰石、石英、粘土 | |
| C. | 玻璃不是晶体 | |
| D. | 玻璃没有一定的熔点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为控制水浴温度为85~90℃,把温度计插入反应液中 | |
| B. | 为除去阿司匹林中混有的杂质,可在粗产品中加足量NaHCO3溶液、搅拌、过滤、洗涤沉淀,干燥即得精品 | |
| C. | 一定条件下,1mol阿司匹林最多可与2mol的NaOH反应 | |
| D. | 可用FeCl3溶液检验阿司匹林中是否含有未反应完的水杨酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | F | G | I | |||
| 3 | B | C | H |
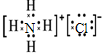 .
. →
→ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16a mol-1 | B. | $\frac{16}{a}$ | C. | ($\frac{16}{a}$) mol-1 | D. | 16 a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com