
【题目】甲醇可作为燃料电池的原料,以CH4和H2O为原料,通过下列反应来制备甲醇:
CH4(g)+H2O(g)═CO(g)+3H2(g) △H=+206.0kJmol-1
CO(g)+2H2(g)═CH3OH(g) △H=-129.0kJmol-1
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为______。
(2)甲醇对水质会造成一定污染,有一种电化学法可消除这种污染,其原理是通电后,将Co2+氧化成Co3+,然后以Co3+作氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置模拟上述过程:

①完成除去甲醇的离子方程式:______
Co3++CH3OH+H2O═Co2++……
②若如图装置中的电源为甲醇—空气—KOH溶液的燃料电池,则电池负极的电极反应式:___。
【答案】CH4(g)+H2O(g)=CH3OH(g)+H2(g)△H=+77.0 kJ/mol 6Co3++CH3OH+H2O=CO2↑+6Co2++6H+ CH3OH-6e-+8OH-=CO32-+6H2O
【解析】
(1)依据热化学方程式和盖斯定律计算;
(2)①通电后,将Co2+氧化成Co3+,Co3+将CH3OH氧化成CO2,自身被还原成Co2+,结合电子守恒、原子守恒和电荷守恒书写离子方程式;
②甲醇在负极发生失电子的氧化反应,结合介质、守恒书写电极反应式。
(1)①CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.0kJ/mol
②CO(g)+2H2(g)=CH3OH(g)△H=-129.0 kJ/mol
根据盖斯定律,将①+②得CH4(g)+H2O(g)=CH3OH(g)+H2(g)△H=+206.0kJ/mol-(-129.0kJ/mol)=+77.0 kJ/mol,
故答案为:CH4(g)+H2O(g)=CH3OH(g)+H2(g)△H=+77.0 kJ/mol;
(2)①甲醇被氧化生成二氧化碳,Co3+被还原生成Co2+,溶液呈酸性,则生成物中含有氢离子,所以该反应离子方程式为6Co3++CH3OH+H2O=CO2↑+6Co2++6H+,
故答案为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
②正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+H2O+4e-═4OH-,负极是甲醇失电子在碱溶液中生成碳酸根,故答案为:CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O。


科目:高中化学 来源: 题型:
【题目】甲苯(![]() )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(![]() )、苯甲酸(
)、苯甲酸(![]() )等产品。下表列出了有关物质的部分物理性质,请回答:
)等产品。下表列出了有关物质的部分物理性质,请回答:

注:甲苯、苯甲醛、苯甲酸三者互溶。
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入2mL甲苯和一定量其它试剂,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。

(1)装置a的名称是_____,主要作用是________。三颈瓶中发生反应的化学方程式为_______。
(2)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是_________。
(3)反应完毕,反应混合液经过自然冷却至室温后,还应经过__________、________(填操作名称)等操作,才能得到苯甲醛粗产品。
(4)实验中加入过量的过氧化氢并延长反应时间时,会使苯甲醛产品中产生较多的苯甲酸。
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的实验步骤是______(按步骤顺序填字母)。
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2 d.与适量碳酸氢钠溶液混合振荡
②若对实验①中获得的苯甲酸(相对分子质量为122)产品进行纯度测定,可称取2.500g产品,溶于200mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000 mol/L KOH标准液滴定,到达滴定终点时消耗KOH溶液18.00mL。产品中苯甲酸的质量分数为_______(保留一位小数)。下列情况会使测定结果偏低的是____(填字母)。
a.滴定终了俯视读取数据 b.KOH标准液长时间接触空气
c.配制KOH标准液时仰视定容 d.将指示剂换为甲基橙溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《化学与生活》合理膳食,保持营养均衡,是青少年学生健康成长的重要保证。
(1)蛋白质是人体必需的营养物质,它在人体内最终分解为_______
A.葡萄糖 B.氨基酸 C.脂肪酸
(2)现有下列五种物质:
A.食盐 B.食醋 C.苹果汁 D.葡萄糖 E.青霉素
请按下列要求填空(填序号)。
富含维生素C的是________;可直接进入血液,补充能量的是_______ ;应用最广泛的抗生素之一的是_______;即可作为调味剂,又可作为防腐剂的是_______;食用过多会引起血压升高、肾脏受损的_________。
(3)鸡蛋含有丰富的蛋白质,它在人体内消化过程如下:
![]()
请回答下列问题:
a.向鸡蛋清溶液中滴入几滴浓硝酸,微热,鸡蛋清变为________色。
b.氨基酸具有两性,是因为氨基酸分子中既含有碱性官能团又含有酸性官能团,其中,碱性官能团是____________,酸性官能团是____________。
c.向鸡蛋清溶液中加入饱和Na2SO4溶液,有白色沉淀产生,发生的是_______(填“盐析”或“变性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的方案可以降低铁闸门的腐蚀速率。下列判断正确的是( )
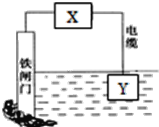
A.若X为导线,Y可以是锌
B.若X为导线,铁闸门上的电极反应式为Fe-2e-=Fe2+
C.若X为直流电源,铁闸门做负极
D.若X为直流电源,Y极上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、烟道气中的NOx是主要的大气污染物之一,为了监测其含量,选用如下检测方法。回答下列问题:将vL气样通入适量酸化的H2O2溶液中,恰好使NOx完全被氧化成NO3-,加水稀释至100.00mL。量取20.00mL该溶液,加入v1mLc1mol·L-1FeSO4标准溶液(过量),充分反应后,用c2mol·L-1 K2Cr2O7标准溶液滴定剩余的Fe2+,终点时消耗v2mL。
(1)NO被H2O2氧化为NO3-的离子方程式为___。
(2)加水稀释到100.00ml所用的玻璃仪器除量筒、烧杯、玻璃棒、胶头滴管外,还需要___;滴定操作使用的玻璃仪器主要有___。
(3)滴定过程中发生下列反应:3Fe2++NO3-+4H+=NO↑+3Fe3++2H2O、Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
则气样中NOx的物质的量为___mol。
(4)下列操作会使滴定结果偏高的是___
A.滴定管未用标准液润洗
B.锥形瓶洗净后还存留少量的水
C.滴定管滴定前读数正确,滴定后俯视读数
D.FeSO4标准溶液部分变质
II、常温下,用酚酞作指示剂,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1的 CH3COOH溶液和HCN溶液所得滴定曲线如图。

(已知:CH3COOH、 HCN的电离平衡常数分别为1.75×10-5、6.4×10-10)
(1)图___(a或b)是NaOH溶液滴定HCN溶液的pH变化的曲线。
(2)点③所示溶液中所含离子浓度的从大到小的顺序:___。
(3)点①和点②所示溶液中:c(CH3COO-)-c(CN-)___c(HCN)-c(CH3COOH)(填“>、<或=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知Ksp(AgCl)=1.8×10-10,则将AgCl放在蒸馏水中形成饱和溶液,溶液中的c(Ag+)是________?
(2)已知Ksp[Mg(OH)2]=1.8×10-11,则将Mg(OH)2放入蒸馏水中形成饱和溶液,溶液的pH为________?
(3)在0.01 mol·L-1的MgCl2溶液中,逐滴加入NaOH溶液,刚好出现沉淀时,溶液的pH是________?当Mg2+完全沉淀时,溶液的pH为________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4种相邻的主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性。回答下列问题:
m | n | ||
x | y |
(1)元素x在周期表中的位置是第____。其单质可采用电解熔融的___方法制备。用电子式表示该化合物的形成过程:___。
(2)m、n、y三种元素最高价氧化物的水化物中,酸性最强的是____,碱性最强的是____。(填化学式)
(3)气体分子(mn)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.pH相等的CH3COONa、NaOH和Na2CO3三种溶液浓度大小关系为:c(NaOH)<c(CH3COONa)<c(Na2CO3)
B.0.1 mol/L的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
C.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
D.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com