
(1)写出热化学方程式____________________________。
(2)已知H2O(l)![]() H2O(g);ΔH=+44 kJ·mol-1,则16 g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是_________kJ。
H2O(g);ΔH=+44 kJ·mol-1,则16 g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是_________kJ。
(3)上述反应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是_____________________________________________。
科目:高中化学 来源: 题型:
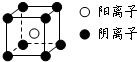 短周期元素A、B、C、D、E、F,原子序数依次增大.已知:①A与E同主族,E的单质与D2反应可生成E2D和E2D2两种固体;②F的单质在D2中燃烧的产物可使品红溶液褪色;B的单质在D2中燃烧可生成BD和BD2两种气体;③CA4++DA-=CA3↑+A2D,各种反应和生成物的电子数都与E+相等.请回答下列问题:
短周期元素A、B、C、D、E、F,原子序数依次增大.已知:①A与E同主族,E的单质与D2反应可生成E2D和E2D2两种固体;②F的单质在D2中燃烧的产物可使品红溶液褪色;B的单质在D2中燃烧可生成BD和BD2两种气体;③CA4++DA-=CA3↑+A2D,各种反应和生成物的电子数都与E+相等.请回答下列问题:



| ||
| 2 |
| 3 |
| ||
| ||
| 2 |
| 3 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
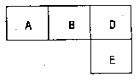 有M、A、B、D、N、E五种短周期元素,原子序数依次增大.M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期原子半径最大的.A、B、D、E分别在表(周期表的一部分)占有相应的位置,它们的原子序数之和为37.试回答:
有M、A、B、D、N、E五种短周期元素,原子序数依次增大.M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期原子半径最大的.A、B、D、E分别在表(周期表的一部分)占有相应的位置,它们的原子序数之和为37.试回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com