
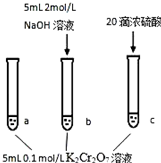
 某同学Cr2O72-(aq)+H2O(l)?2CrO42-(aq)+2H+(aq)△H=+13.8kJ/mol
某同学Cr2O72-(aq)+H2O(l)?2CrO42-(aq)+2H+(aq)△H=+13.8kJ/mol| A. | 该反应是一个氧化还原反应 | |
| B. | 待试管b中溶液颜色不变的目的是使Cr2O72-完全反应 | |
| C. | 该实验不能证明减小生成物浓度,平衡正向移动 | |
| D. | 试管c中的现象说明影响平衡的主要因素是温度 |
分析 A.反应中无元素的化合价变化;
B.该反应为可逆反应;
C.滴加浓硫酸,放出热量,温度、浓度均影响平衡移动;
D.试管c中温度、氢离子浓度均变化.
解答 解:A.反应中无元素的化合价变化,为非氧化还原反应,故A错误;
B.该反应为可逆反应,b中溶液颜色不变的目的是不能使Cr2O72-完全反应,故B错误;
C.滴加浓硫酸,放出热量,温度、浓度均影响平衡移动,则该实验不能证明减小生成物浓度,平衡正向移动,可能升高温度平衡正向移动,故C正确;
D.试管c中温度、氢离子浓度均变化,则c中的现象不能说明影响平衡的主要因素是温度,故D错误;
故选C.
点评 本题考查化学平衡的影响因素,为高频考点,把握可逆反应的特点、温度和浓度对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意判断存在的变量,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 | |
| B. | 向氯化银的悬浊液中加入氯化钠溶液,氯化银的Ksp减小 | |
| C. | 向0.0008mol•L-1的K2CrO4溶液中加入等体积0.002 mol•L-1的AgNO3溶液,则CrO42-完全沉淀 | |
| D. | 将0.001mol•L-1AgNO3溶液滴入浓度均为0.001 mol•L-1的KCl和K2CrO4混合溶液中,则先产生AgCl沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
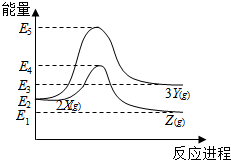
| A. | 由X→Y反应的△H=E5-E2 | B. | 由X→Z反应的△H>0 | ||
| C. | 降低压强有利于提高Y的产率 | D. | 升高温度有利于提高Z的产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
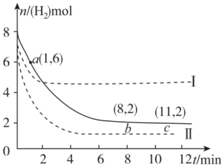
| A. | 若曲线I对应的条件改变是升高温度,则该反应△H>0 | |
| B. | 曲线II对应的条件改变是降低压强 | |
| C. | 反应开始至a点时v(H2)=1mol•L-1•min-1 | |
| D. | 保持温度不变,若将平衡后的容器体积缩小至1L,重新达平衡时则2 mol•L-1<c(CH3OH)<$\frac{8}{3}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +2 | B. | +3 | C. | +4 | D. | +6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水鉴别乙醇和溴苯 | |
| B. | 用红外光谱鉴别丙醛和1-丙醇 | |
| C. | 用溴水鉴别苯和正庚烷 | |
| D. | 用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钡、四氯化碳、硫酸、碘酒都属于化合物 | |
| B. | 硝酸、纯碱、磷酸钠、二氧化碳分别属于酸、碱、盐、氧化物 | |
| C. | 溶液、浊液、胶体、空气都属于混合物 | |
| D. | CO2、SO2、P2O5、CO都属于酸性氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com